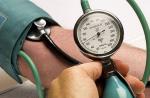
میکروسکوپ نوری قدیمی ترین و در عین حال یکی از رایج ترین روش های تحقیق و بررسی سلول های گیاهی و جانوری است. فرض بر این است که آغاز مطالعه سلول دقیقاً با اختراع میکروسکوپ نوری نوری بوده است. مشخصه اصلی میکروسکوپ نوری قدرت تفکیک میکروسکوپ نوری است که با طول موج نور مشخص می شود. حد تفکیک یک میکروسکوپ نوری با طول موج نور تعیین می شود، یک میکروسکوپ نوری برای مطالعه سازه هایی استفاده می شود که دارای حداقل اندازه برابر با طول موج تابش نور هستند. بسیاری از سلول های تشکیل دهنده از نظر چگالی نوری نزدیک هستند و قبل از میکروکپی نیاز به درمان اولیه دارند، در غیر این صورت عملاً در میکروسکوپ نوری معمولی نامرئی هستند. برای نمایان شدن آنها از رنگهای مختلف با گزینش پذیری خاصی استفاده می شود. با استفاده از رنگ های انتخابی، می توان ساختار داخلی سلول را با جزئیات بیشتری مطالعه کرد.
برای مثال:
رنگ هماتوکسیلین برخی از اجزای هسته را به رنگ آبی یا بنفش رنگ می کند.
پس از درمان متوالی با فلوروگلوسینول و سپس با اسید هیدروکلریک، غشای سلولی lignified تبدیل به قرمز گیلاس می شود.
رنگ سودان III غشاهای سلولی چوب پنبه ای را صورتی رنگ می کند.
محلول ضعیف ید در یدید پتاسیم دانه های نشاسته را آبی می کند.
هنگام انجام معاینات میکروسکوپی، بیشتر بافت ها قبل از رنگ آمیزی ثابت می شوند.
پس از تثبیت، سلول ها نسبت به رنگ ها نفوذپذیر می شوند و ساختار سلولی تثبیت می شود. یکی از رایج ترین فیکساتورها در گیاه شناسی اتیل الکل است.
در طول آماده سازی آماده سازی برای میکروکپی، برش های نازکی بر روی میکروتوم ساخته می شود (پیوست 1، شکل 1). این دستگاه از اصل برش نان استفاده می کند. بخشهای کمی ضخیمتر برای بافتهای گیاهی نسبت به حیوانات ساخته میشوند، زیرا سلولهای گیاهی نسبتاً بزرگتر هستند. ضخامت بخش های بافت گیاهی برای - 10 میکرون - 20 میکرون. برخی از پارچه ها خیلی نرم هستند و نمی توان آنها را بلافاصله برش داد. بنابراین، پس از تثبیت، آنها را در پارافین مذاب یا یک رزین مخصوص می ریزند که کل پارچه را آغشته می کند. پس از خنک شدن، یک بلوک جامد تشکیل می شود که سپس روی میکروتوم برش داده می شود. این به دلیل این واقعیت است که سلول های گیاهی دارای دیواره های سلولی قوی هستند که چارچوب بافت را تشکیل می دهند. پوسته های لگن شده به ویژه بادوام هستند.
استفاده از پر کردن در حین پخت، برش خطر نقض ساختار سلول را افزایش می دهد، برای جلوگیری از این امر از روش انجماد سریع استفاده می شود. هنگام استفاده از این روش، از تثبیت و ریختن صرف نظر می شود. بافت منجمد بر روی یک میکروتوم ویژه - یک کرایوتوم (پیوست 1، شکل 2) بریده می شود.
بخش های یخ زده ویژگی های ساختار طبیعی را بهتر حفظ می کنند. با این حال، پختن آنها دشوارتر است و وجود کریستال های یخ برخی از جزئیات را می شکند.
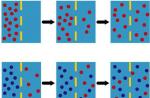
فاز کنتراست (برنامه 1، شکل 3) و میکروسکوپ تداخلی (برنامه 1، شکل 4) به شما امکان می دهد سلول های زنده را در زیر میکروسکوپ با جلوه ای واضح از جزئیات ساختار آنها بررسی کنید. این میکروسکوپها از 2 پرتو امواج نوری استفاده میکنند که بر یکدیگر اثر متقابل دارند و دامنه امواجی که از اجزای مختلف سلول وارد چشم میشوند را افزایش یا کاهش میدهند.
میکروسکوپ نوری انواع مختلفی دارد.
تمرین 1.
طرح پیشنهادی جهت تکامل را در نظر بگیرید. در جواب عبارت گم شده را بنویسید که با علامت سوال در نمودار مشخص شده است.
توضیح:یک خط نادیده گرفته شده از پیشرفت بیولوژیکی، سازگاری است. IdioAptation- تغییر خاصی در ارگانیسم که منجر به افزایش سطح سازمان نمی شود (بلوغ برگ ها، تغییر رنگ و غیره).
پاسخ صحیح idioaptation است.
وظیفه 2.
از بین پنج پاسخ، دو پاسخ صحیح را انتخاب کنید و اعدادی را که در زیر آنها نشان داده شده اند بنویسید.
با کمک میکروسکوپ نوری در یک سلول گیاهی می توان تشخیص داد.
1. شبکه آندوپلاسمی
2. میکروتوبول ها
3. واکوئل
4. دیواره سلولی
5. ریبوزوم ها
توضیح:با استفاده از میکروسکوپ نوری، تنها بخشهای بزرگی از سلول، مانند دیواره سلولی و واکوئل، قابل تشخیص هستند (در سلولهای قدیمی، واکوئل تقریباً کل فضای داخل سلولی را اشغال میکند). اندامکهای کوچکتر (ریز لولهها، شبکه آندوپلاسمی و ریبوزومها) فقط با میکروسکوپ الکترونی قابل مشاهده هستند.
پاسخ صحیح 34 است.
وظیفه 3.
اگر مجموعه دیپلوئیدی حاوی 46 مولکول DNA باشد، پس از همانندسازی، چند مولکول DNA در هسته سلول وجود دارد؟ فقط عدد مناسب را در پاسخ خود بنویسید.
توضیح:همانند سازی - دو برابر شدن مولکول های DNA، به این معنی که 46 مولکول پس از دو برابر شدن به 92 مولکول تبدیل می شوند.
پاسخ صحیح 92 است.
وظیفه 4.
تمام علائم ذکر شده در زیر، به جز دو مورد، برای توصیف ساختار و عملکرد شبکه آندوپلاسمی استفاده می شود. دو ویژگی را که از لیست کلی "خارج می شوند" شناسایی کنید.
1. تجزیه پروتئین ها
2. حمل و نقل مواد
3. فسفوریلاسیون اکسیداتیو
4. سنتز پروتئین روی ریبوزوم ها
5. جداسازی سیتوپلاسم به محفظه ها
توضیح:شبکه آندوپلاسمی هسته را احاطه می کند، در نتیجه سیتوپلاسم را به بخش هایی تقسیم می کند و حمل و نقل درون سلولی مواد را انجام می دهد. EPS صاف و خشن است. Rough ER سنتز پروتئین ها را با کمک ریبوزوم هایی که روی غشاهای شبکه قرار دارند انجام می دهد.
پاسخ صحیح 13 است.
وظیفه 5.
ارتباطی بین فرآیندها و مراحل میتوز ایجاد کنید.
فرآیندها
الف- غشای هسته ای تشکیل می شود
ب- کروموزوم های خواهر واگرا می شوند
ب- دوک تقسیم سرانجام ناپدید می شود
D. کروموزوم ها مست می شوند
د) سانترومرهای کروموزوم ها از هم جدا می شوند
مراحل میتوز
1. آنافاز
2. تلوفاز
توضیح:آنافاز سریعترین مرحله تقسیم است، زیرا کروموزوم ها از قطب های سلول جدا می شوند (و سانترومرهای کروموزوم ها جدا می شوند). تمام فرآیندهای دیگر پس از واگرایی کروموزوم ها - در تلوفاز اتفاق می افتد.
پاسخ صحیح 21221 است.
وظیفه 6.
چه تعداد فنوتیپ مختلف با تلاقی دو گیاه نخود شیرین هتروزیگوت با گلهای صورتی (قرمز به طور ناقص بر سفید غالب است) تولید می شود. در پاسخ خود فقط تعداد فنوتیپ ها را یادداشت کنید.
توضیح:با تسلط ناقص، ترکیب ژنهای رنگهای قرمز (A) و سفید (a) رنگ صورتی (A) را میدهد. ما از دو گیاه کت صورتی عبور می کنیم:
R: Aa x Aa
G: A، a x A، a
F1: ما بر اساس ژنوتیپ تقسیم می شویم - 1AA:2Aa:1aa
تقسیم بر اساس فنوتیپ: 1: 2: 1 (25٪ - قرمز، 50٪ - صورتی، 25٪ - گل های سفید).
پاسخ صحیح 3 است.
وظیفه 7.
همه نشانه های زیر، به جز دو مورد، تغییرپذیری اصلاح را مشخص می کنند. دو علامت را که از فهرست کلی "خارج می شوند" شناسایی کنید و اعدادی را که در زیر آنها نشان داده شده اند بنویسید.
1. اشکال مختلف برگ های نوک پیکان زیر آب و بیرون زده
2. چشمان قهوه ای و آبی در اعضای یک خانواده
3. تنوع در اندازه غده های یک گیاه سیب زمینی
4. اختلاف طول برگ های توس از سمت شمال و جنوب
5. داشتن فرزندان مبتلا به سندرم داون
توضیح: تغییرپذیری اصلاح- تنوع یک ارگانیسم خاص (یا گروهی از موجودات) بسته به شرایط محیطی در محدوده هنجار واکنش. چنین تنوعی بر فنوتیپ ارگانیسم تأثیر می گذارد، اما بر ژنوتیپ تأثیر نمی گذارد، بنابراین چنین تغییراتی ارثی نیستند. بنابراین، نمونه هایی از این نوع تنوع نمی تواند صفات ژنتیکی باشد - رنگ چشم متفاوت و سندرم داون.
پاسخ صحیح 25 است.
وظیفه 8.
یک مکاتبه بین فرآیندها و بخش های کارخانه ایجاد کنید.
فرآیندها
الف. تشکیل آندوسپرم
ب- تشکیل رشد سبز
ب- همجوشی گامت های غیر متحرک
د. توسعه لوله گرده
د. تولید مثل و پراکندگی توسط هاگ
بخش های گیاهی
2. سرخس
توضیح:سرخس ها رشد سبز رنگی را تشکیل می دهند (از هاگ ها) و همچنین تکثیر می شوند و توسط هاگ ها ته نشین می شوند. سلول های تناسلی مردانه آنها متحرک است و لقاح فقط در آب انجام می شود.
پاسخ صحیح 12112 است.
وظیفه 9.
ویژگی های ارگانیسم نشان داده شده در شکل چیست؟

1. سیستم گردش خون بسته
2. تقسیم بدن به سر، سینه و شکم
3. طناب عصبی شکم
4. چهار جفت پا
5. یک جفت آنتن
6. تنفس با کیسه های ریه و نای
توضیح:عنکبوتیان دارای چهار جفت پا، سیستم گردش خون باز، قسمت های بدن: سفالوتوراکس و شکم هستند، یک زنجیره عصبی شکمی وجود دارد، آنها با کمک کیسه های ریه و نای تنفس می کنند. سبیل وجود ندارد.
پاسخ صحیح 346 است.
وظیفه 10.
بین ویژگیهای موجودات و پادشاهیهایی که برای آنها مشخص هستند، مطابقت برقرار کنید.
نشانه های موجودات
الف- نوع تغذیه هتروتروف
ب- وجود کیتین در اسکلت بیرونی
ب- وجود بافت آموزشی
د-تنظیم فعالیت حیاتی فقط با کمک مواد شیمیایی
د- تشکیل اوره در فرآیند متابولیسم
E. وجود دیواره سلولی سفت و سخت ساخته شده از پلی ساکاریدها
پادشاهی ها
1. گیاهان
2. حیوانات
توضیح:علائم حیوانات شامل نوع تغذیه هتروتروف، وجود کیتین در اسکلت خارجی و تشکیل اوره در فرآیند متابولیسم پروتئین است.
وجود بافت آموزشی، تنظیم فعالیت حیاتی با کمک مواد شیمیایی و وجود دیواره سلولی را می توان به نشانه های گیاهان نسبت داد.
گیاهان اتوتروف هستند، زیرا مواد معدنی را مصرف می کنند و آنها را به مواد آلی تبدیل می کنند. اسکلت خارجی فقط در حیوانات (بندپایان) وجود دارد، در حیوانات فقط بافت عصبی، اپیتلیال، عضلانی و همبند وجود دارد و در گیاهان - آموزشی، مکانیکی، پوششی، اساسی و رسانا. حیوانات با کمک تنظیم عصبی و هومورال فرآیندهای درونی را تنظیم می کنند و گیاهان فقط با کمک مواد شیمیایی. اوره در حیوانات تشکیل می شود. دیواره سلولی (ساخته شده از سلولز) در گیاهان وجود دارد و در حیوانات وجود ندارد.
پاسخ صحیح 221121 است.
وظیفه 11.
ترتیب ترتیب طبقه بندی سیستماتیک را با بزرگترین شروع کنید.
1. گیاهان
2. درختچه گیلاس
3. روزاسه
4. دو لپه ای
5. آنژیوسپرم ها
6. گیلاس
توضیح:طبقه بندی را ترتیب دهید، با بزرگترین شروع کنید.
پادشاهی - گیاهان
بخش - آنژیوسپرم ها
طبقه - دو لپه ای
خانواده - Rosaceae
راد - گیلاس
نما - درختچه گیلاس
پاسخ صحیح 154362 است.
وظیفه 12.
از بین شش پاسخ، سه پاسخ صحیح را انتخاب کنید و اعدادی را که زیر آنها نشان داده شده اند، یادداشت کنید.
1. تنگ شدن شریان های ریوی
2. افزایش تنفس
3. تبخیر آب از طریق غدد عرق
4. تغییر در میزان لخته شدن خون
5. گسترش مویرگ های پوست
6. کاهش فشار خون
توضیح:در طی انتقال حرارت، شریان های ریوی باریک می شوند (به دلیل افزایش فشار)، تبخیر آب از طریق غدد عرق و انبساط مویرگ های پوست (پوست قرمز می شود).
پاسخ صحیح 135 است.
وظیفه 13.
یک مکاتبه بین ساختار گوش و بخش هایی که در آن قرار دارند برقرار کنید.
ساختار
الف. پینا
ب- پنجره بیضی شکل
V. حلزون
G. Stremechko
د. شیپور استاش
ای. چکش
بخش ها
1. گوش خارجی
2. گوش میانی
3. گوش داخلی
توضیح:بیایید به تصویر نگاه کنیم

گوش را به گوش داخلی، استخوانچه های شنوایی (رکاب چکشی) را به گوش میانی، پنجره بیضی شکل، حلزون گوش و شیپور استاش را به گوش داخلی ارجاع می دهیم.
پاسخ صحیح 133232 است.
وظیفه 14.
به ترتیب صحیح زیر مجموعه سیستم های سطوح مختلف را ترتیب دهید که از بزرگترین آنها شروع می شود.
1. عناصر شکل
2. اریتروسیت
3. هموگلوبین
4. یون آهن
5. بافت همبند
6. خون
توضیح:ما ساختارها را مرتب می کنیم و از بزرگترین آنها شروع می کنیم: بافت همبند - خون - عناصر تشکیل شده - گلبول های قرمز - هموگلوبین - یون آهن. آهن بخشی از پروتئین هموگلوبین است که اکسیژن را حمل می کند و روی گلبول قرمز - یک سلول خونی قرار دارد. خون یکی از انواع بافت همبند است.
پاسخ صحیح 561234 است.
وظیفه 15.
متن را بخوان. سه جمله را انتخاب کنید که معیار اکولوژیکی گونه گیاهی Pemphigus vulgaris را توصیف کند. اعدادی را که زیر آنها نشان داده شده اند بنویسید.
1. Pemphigus vulgaris عمدتا در منطقه مدیترانه اروپا و آفریقا یافت می شود. 2. Pemphigus vulgaris در گودال ها، برکه ها، مخازن راکد و به آرامی جریان، مرداب ها رشد می کند. 3. برگ های گیاهان را به لوب های نخ مانند متعدد جدا می کنند، برگ ها و ساقه ها با وزیکول ها ارائه می شوند. 4. پمفیگوس از ژوئن تا سپتامبر شکوفا می شود. 5. گل ها به رنگ زرد رنگ می شوند، 5-10 در هر دمگل نشسته اند. 6. پمفیگوس ولگاریس گیاهی حشره خوار است.
توضیح:یک معیار اکولوژیکی روش زندگی یک گونه را از طریق ارتباط آن با سایر موجودات توصیف می کند. جمله 2 - ویژگی های زیستگاه (نه مکان های خاص، بلکه به طور کلی) را توصیف می کند.
پیشنهاد 4 - زمان گلدهی (و در نتیجه گرده افشانی).
پیشنهاد 6 - ویژگی های تغذیه ای.
پاسخ صحیح 246 است.
وظیفه 16.
مثال ها و شواهدی را برای تکامل مطابقت دهید.
مثال ها
الف. اشکال انتقالی فسیلی
ب. اندامهای همولوگ
ب. مبانی
د. فسیل ها
د. آتاویسم ها
ه. طرح تک بدنه
شواهدی برای تکامل
1. دیرینه شناسی
2. تشریحی مقایسه ای
توضیح:به شواهد دیرینه شناسی ما به آنچه دانشمندان یافته اند - اشکال انتقالی فسیلی، فسیل ها اشاره می کنیم. همه چیزهای دیگر شواهد تشریحی مقایسه ای هستند - اندام های همولوگ، ابتدایی ها، آتاویسم ها، یک طرح ساختاری واحد.
آتاویسم- ظهور علائم در بدن مشخصه اجداد دور (خط مو، چند پستان و غیره).
مقدمات- اندام هایی که عملکرد خود را از دست داده اند (دندان عقل، آپاندیس، دنبالچه، پلک سوم و غیره).
پاسخ صحیح 122122 است.
وظیفه 17.
از بین شش پاسخ، سه پاسخ صحیح را انتخاب کنید و اعدادی را که زیر آنها نشان داده شده اند، یادداشت کنید.
مصرف کنندگان در یک اکوسیستم هستند
2. پوسیدگی باکتری
3. گیاهان سبز
4. آرتیوداکتیل ها
5. شکارچیان
6. سیانوباکترها
پاسخ صحیح 145 است.
وظیفه 18.
ارتباطی بین صفات و اکوسیستم ها برقرار کنید.
نشانه ها
الف-شبکه های برق منشعب
ب- زنجیره های غذایی کوتاه
ب- خودتنظیمی پایین
د- تنوع تولیدکنندگان
د. تنوع گونه ای جانوران
ه- تسلط تک کشت ها
اکوسیستم ها
1. استپی پر-علف
2. مزرعه گندم
توضیح:در واقع، در این کار باید اکوسیستم طبیعی (استپ علف پر) را از اکوسیستم کشاورزی (مزرعه گندم) متمایز کرد.
اکوسیستم کشاورزی با زنجیره های غذایی کوتاه، خودتنظیمی پایین و تسلط تک کشت ها مشخص می شود. هر چیز دیگری نشانه یک اکوسیستم طبیعی پایدار است.
پاسخ صحیح 122112 است.
وظیفه 19.
ترتیب ظهور و توسعه اکوسیستم ها را بر روی سنگ های لخت ایجاد کنید.
1. گلسنگ ها و باکتری ها را فلس کنید
2. جامعه علفی- بوته ای
3. جامعه جنگل
4. گیاهان گلدار علفی
5. خزه ها و گلسنگ های فروتیکوز
توضیح:روی صخره های برهنه، یک جامعه گیاهی به همان شکلی که زندگی گیاهی روی زمین ایجاد می شود، تشکیل می شود. یعنی گلسنگ ها و باکتری های فلس دار، سپس خزه ها و گلسنگ های فروتیکوز، سپس گیاهان گلدار علفی، جامعه علفی-بوته ای و در نهایت جامعه جنگلی.
پاسخ صحیح 15423 است.
وظیفه 20.
نقاشی را در نظر بگیرید که فاز چرخه قلبی را نشان می دهد. نام این فاز، مدت زمان و جهت جریان خون را مشخص کنید. سلول های خالی جدول را با استفاده از اصطلاحات فرآیند از لیست پر کنید.
فهرست شرایط و فرآیندها:
1. سیستول بطنی
2. سیستول دهلیزی
3. جریان خون از بطن ها به شریان ها
4. 0.1 ثانیه
5.0.8 ثانیه
6. جریان خون از دهلیز به بطن
7. جریان خون از سیاهرگ ها به دهلیز
8.0.3 ثانیه
توضیح:شکل مرحله انقباض دهلیزی (سیستول دهلیزی) را نشان می دهد. در این حالت خون از دهلیز وارد بطن می شود. این فرآیند بسیار سریع است و 0.1 ثانیه طول می کشد.
پاسخ صحیح 246 است.
وظیفه 21.
جدول "زمان لازم برای تشخیص تصویر آزمایشی" را تجزیه و تحلیل کنید. به سوژهها تعداد رنگهای مختلف و تصاویر سیاه و سفید با پیچیدگیهای متفاوت نشان داده شد. زمان مورد نیاز برای شناسایی و نامگذاری شی توسط آزمودنی ثبت شد.
|
تصاویر |
میانگین زمان تشخیص (ms) |
|
ساده |
25,0 |
|
درجه سختی متوسط |
37,5 |
|
مجتمع |
70,0 |
|
اعداد سیاه |
27,5 |
|
اعداد قرمز |
37,5 |
|
اعداد آبی |
62,5 |
|
اعداد سبز |
45,0 |
|
اعداد زرد |
67,5 |
عباراتی را انتخاب کنید که بتوان بر اساس تجزیه و تحلیل داده های ارائه شده فرموله کرد.
1. زمان تشخیص اعداد به رنگ آنها بستگی ندارد
2. اشیاء سیاه سریعتر از رنگی تشخیص داده می شوند
3. هر چه جسم ساده تر باشد، نور کمتری برای تشخیص آن نیاز است.
4. اعداد رنگی سریعتر از تصاویر پیچیده تشخیص داده می شوند
5. هنگام غروب، تشخیص یک شی رنگی ضعیف می شود
توضیح:بر اساس داده های داده شده در جدول، اشیاء سیاه سریعتر از اشیاء رنگی شناسایی می شوند (27.5 میلی ثانیه و 37.5 - 67.5 میلی ثانیه). و اعداد رنگی (حداکثر - 67.5 میلیثانیه سریعتر از یک تصویر پیچیده (70.0 میلیثانیه) شناسایی میشوند. بقیه عبارات یا درست نیستند یا حاوی دادههایی هستند که در جدول وجود ندارد.
پاسخ صحیح 24 است.
وظیفه 22.
به خوبی شناخته شده است که خون انسان حاوی پروتئین و گلوکز است. چرا یک بار تزریق گلوکز به خون برای بدن خطرناک نیست، اما وارد کردن اکثر پروتئین ها خطرناک است؟
توضیح:با یک بار ورود گلوکز به خون، هورمون های متابولیسم کربوهیدرات آن را تجزیه می کنند. گلوکز یک مولکول آشنا برای خون انسان (و مولکول اصلی انرژی) است و پروتئین ها (نه تنظیم کننده) نباید در حالت طبیعی در خون باشند (از آنجایی که پلیمر هستند)، مونومرهای پروتئین - اسیدهای آمینه - وارد خون می شوند. دستگاه گوارش پروتئین ها در طبیعت آنتی ژنی هستند و توسط بدن انسان به عنوان یک مولکول خارجی درک می شوند.
وظیفه 23.
شی نشان داده شده در تصویر را نام ببرید. نام و عملکرد ساختارهای موجود در تصویر را مشخص کنید.

توضیح:شکل یک باکتریوفاژ (ویروس باکتری) را نشان می دهد. ما می توانیم سر را تشخیص دهیم (کپسید پروتئین - عملکرد محافظتی را انجام می دهد، زیرا حاوی یک اسید نوکلئیک - DNA یا RNA است). فرآیند دم با یک صفحه پایه - از طریق فرآیند، ویروس اسید نوکلئیک را به سلول آسیب دیده تزریق می کند. فیبریل ها - با کمک آنها، ویروس روی دیواره سلولی ریشه می گیرد.
وظیفه 24.
سه خطا در متن داده شده پیدا کنید. تعداد جملاتی را که در آنها خطا وجود دارد را مشخص کنید، آنها را اصلاح کنید.
(1) ماهی ها ساکنان محیط آبی هستند. (2) با توجه به منشاء و ویژگی های ساختاری ماهی ها به 2 دسته ماهی غضروفی و ماهی استخوانی تقسیم می شوند. (3) سر، به سمت جلو، با بدن ادغام شده است، که از لبه آزاد پوشش آبشش شروع می شود و به ناحیه دمی ختم می شود. (4) در تمام ماهی ها، آبشش ها در قسمت بیرونی بدن با شکاف های آبشش باز می شوند. (5) همه ماهی ها دارای مثانه شنا هستند. ب) کهن ترین ماهیان استخوانی، ماهیان باله دار هستند. (7) آنها با باله های گوشتی و پوسته پوسته، نوتوکورد توسعه یافته در ماهی بالغ، مثانه شنا ضعیف و سایر ویژگی ها مشخص می شوند.
توضیح:جمله 3 - بدن نه با دم، بلکه با مقعد به پایان می رسد.
گزاره 4 - تمام آبشش های ماهی در خارج از بدن با شکاف آبشش باز نمی شوند. در بسیاری از ماهی ها، آبشش ها با پوشش آبشش (ماهی استخوانی) پوشیده شده است.
پیشنهاد 5 - مثانه های شنا - اندامی خاص برای سازگاری با شنا، اما همه ماهی ها مثانه شنا (ماهی قزل آلا) ندارند.
میکروسکوپ برای شناسایی و مطالعه میکروارگانیسم ها استفاده می شود. میکروسکوپ های نوری برای مطالعه میکروارگانیسم هایی با اندازه حداقل 0.2 میکرون (باکتری ها، تک یاخته ها و غیره) و میکروسکوپ های الکترونیکی برای مطالعه میکروارگانیسم های کوچکتر (ویروس ها) و کوچکترین ساختارهای باکتری ها طراحی شده اند.
نوین میکروسکوپ های نوری- اینها دستگاه های نوری پیچیده ای هستند که کار با آنها به دانش، مهارت و دقت بالایی نیاز دارد.
میکروسکوپ های نوری به دو دسته دانشجویی، کاری، آزمایشگاهی و تحقیقاتی تقسیم می شوند که از نظر طراحی و اپتیک متفاوت هستند. میکروسکوپ های خانگی (Biolam، Bimam، Mikmed) دارای علامت هایی هستند که نشان می دهد به کدام گروه تعلق دارند (C - دانشجو، R - کارگران، L - آزمایشگاه، I - تحقیقات)، تجهیزات با یک عدد نشان داده شده است.
میکروسکوپ به دو بخش مکانیکی و نوری تقسیم می شود.
به قسمت مکانیکیشامل: سه پایه (شامل پایه و نگهدارنده لوله) و لوله نصب شده بر روی آن با هفت تیر برای نصب و تعویض لنز، میز شی برای آماده سازی، دستگاه هایی برای اتصال کندانسور و فیلترهای نور و همچنین مکانیزم های ساخته شده به سه پایه برای درشت (ماکرومکانیسم، ماکرو اسکرو) و خوب
(میکرومکانیسم، میکرو اسکرو) برای جابجایی مرحله شی یا نگهدارنده لوله.
بخش نوریمیکروسکوپ با اهداف، چشمی ها و یک سیستم روشنایی نشان داده می شود که به نوبه خود از یک کندانسور Abbe واقع در زیر مرحله جسم، یک آینه با یک طرف صاف و مقعر، و همچنین یک روشنگر جداگانه یا داخلی تشکیل شده است. اهداف به هفت تیر پیچ می شوند و چشمی مربوطه که از طریق آن تصویر مشاهده می شود، در طرف مقابل لوله نصب می شود. لوله های تک چشمی (دارای یک چشمی) و دوچشمی (دارای دو چشمی یکسان) وجود دارد.
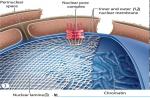
نمودار شماتیک میکروسکوپ و سیستم روشنایی
 1. منبع نور;
1. منبع نور;
2. گردآورنده;
3. دیافراگم میدان عنبیه;
4. آینه;
5. دیافراگم دیافراگم عنبیه;
6. کندانسور;
7. مواد مخدر;
7. تصویر میانی واقعی بزرگ شده از آماده سازی، تشکیل شده توسط هدف.
7"". تصویر نهایی مجازی بزرگ شده از آماده سازی، مشاهده شده در چشمی.
8. لنز;
9. آیکون لنز خروجی.
10. دیافراگم میدانی چشمی;
11. چشمی;
12. چشم.
نقش مهمی در جذب تصویر دارد لنز. این یک تصویر بزرگ، واقعی و معکوس از شی می سازد. سپس این تصویر زمانی که از طریق یک چشمی مشاهده میشود، بزرگتر میشود، که مشابه یک ذرهبین معمولی، یک تصویر مجازی بزرگنمایی میکند.
افزایش دادنمیکروسکوپ را می توان با ضرب بزرگنمایی شیء در بزرگنمایی چشمی به طور تقریبی تعیین کرد. با این حال، بزرگنمایی کیفیت تصویر را تعیین نمی کند. کیفیت تصویر، وضوح آن تعیین می شود وضوح میکروسکوپ، یعنی توانایی تشخیص جداگانه دو نقطه با فاصله نزدیک. محدودیت وضوح- حداقل فاصله ای که این نقاط هنوز به طور جداگانه قابل مشاهده هستند - به طول موج نوری که جسم را روشن می کند و دیافراگم عددی شی بستگی دارد. دیافراگم عددی به نوبه خود به دیافراگم زاویه ای شی و ضریب شکست محیط بین لنز جلویی شی و آماده سازی بستگی دارد. دیافراگم زاویه ای حداکثر زاویه ای است که پرتوهای عبوری از یک جسم می توانند به عدسی وارد شوند. هرچه دیافراگم بزرگتر باشد و ضریب شکست محیط بین لنز و ماده آماده سازی به ضریب شکست شیشه نزدیکتر باشد، وضوح لنز بالاتر است. اگر دیافراگم کندانسور را برابر با دیافراگم شیء در نظر بگیریم، فرمول وضوح به شکل زیر است:
جایی که R حد وضوح است. - طول موج؛ NA - دیافراگم عددی.
تمیز دادن مفیدو بلا استفادهافزایش دادن. بزرگنمایی مفید معمولاً برابر است با دیافراگم عددی شیئی که 500-1000 برابر بزرگنمایی میشود. بزرگنمایی چشمی بیشتر جزئیات جدیدی را نشان نمی دهد و بی فایده است.
بسته به محیطی که بین لنز و آماده سازی قرار دارد، لنزهای "خشک" با بزرگنمایی کوچک و متوسط (تا 40x) و لنزهای غوطه ور با حداکثر دیافراگم و بزرگنمایی (90-100x) وجود دارد. لنز "خشک" عدسی است که هوا بین لنز جلویی و نمونه وجود دارد.

یکی از ویژگی های لنزهای غوطه وری این است که یک مایع غوطه ور بین عدسی جلویی چنین شیئی و آماده سازی قرار می گیرد که دارای ضریب شکستی مشابه شیشه (یا نزدیک به آن) است که افزایش دیافراگم عددی و وضوح را تضمین می کند. از لنز از آب مقطر به عنوان مایع غوطه وری برای لنزهای غوطه ور در آب و از روغن سرو یا روغن غوطه ور مصنوعی مخصوص برای لنزهای غوطه ور در روغن استفاده می شود. استفاده از روغن غوطهوری مصنوعی ترجیح داده میشود، زیرا پارامترهای آن با دقت بیشتری نرمال میشوند و بر خلاف روغن سدر، روی سطح لنز جلوی هدف خشک نمیشود. برای لنزهایی که در ناحیه ماوراء بنفش طیف کار می کنند، گلیسرول به عنوان مایع غوطه وری استفاده می شود. به هیچ وجه نباید از جایگزین های روغن غوطه وری و به ویژه روغن وازلین استفاده کنید.
**تصویر به دست آمده با لنز دارای نواقص مختلفی است: انحرافات کروی و کروماتیک، انحنای میدان تصویر و ... که در لنزهای متشکل از چند عدسی این نواقص تا حدودی اصلاح می شود. بسته به میزان اصلاح این کاستی ها، لنزهای آکروماتیک و عدسی های پیچیده تر آپوکروماتیک متمایز می شوند. بر این اساس به عدسی هایی که انحنای میدان تصویر در آنها اصلاح می شود پلان آکرومات و پلان آپوکرومات می گویند. استفاده از این لنزها تصویر واضحی را در کل میدان ایجاد می کند، در حالی که تصویر به دست آمده با لنزهای معمولی وضوح یکسانی در مرکز و لبه های میدان دید ندارد. تمام مشخصات لنز معمولاً روی قاب آن حک می شود: بزرگنمایی خود، دیافراگم، نوع لنز (APO - apochromat و غیره). لنزهای غوطه ور در آب دارای علامت VI و یک حلقه سفید در اطراف فریم در قسمت پایینی آن هستند، لنزهای غوطه ور روغن دارای علامت MI و یک حلقه سیاه هستند.
همه اهداف برای کار با یک لغزش پوششی 0.17 میلی متری طراحی شده اند.
ضخامت روکش به ویژه در هنگام کار با سیستم های خشک قوی (40x) بر کیفیت تصویر تأثیر می گذارد. هنگام کار با اهداف غوطهوری، نباید از لغزشهای پوششی با ضخامت بیشتر از 0.17 میلیمتر استفاده کرد، زیرا ضخامت لغزش پوشش ممکن است از فاصله کاری هدف بیشتر باشد و در این حالت، زمانی که میخواهید هدف را روی نمونه متمرکز کنید، ممکن است لنز جلوی شیئی آسیب دیده باشد.
چشمی ها از دو عدسی تشکیل شده اند و همچنین انواع مختلفی دارند که هر کدام با نوع خاصی از لنز استفاده می شود و عیوب تصویر را بیشتر از بین می برد. روی قاب آن نوع چشمی و بزرگنمایی آن مشخص شده است.
کندانسور به گونه ای طراحی شده است که نور روشن کننده را بر روی آماده سازی متمرکز کند که توسط آینه میکروسکوپ یا روشن کننده هدایت می شود (در صورت استفاده از روشن کننده متصل یا داخلی). یکی از جزئیات کندانسور دیافراگم دیافراگم است که برای روشنایی مناسب نمونه ضروری است.
روشنگر از یک لامپ رشته ای کم ولتاژ با یک رشته ضخیم، یک ترانسفورماتور، یک لنز جمع کننده و یک دیافراگم میدانی تشکیل شده است که دهانه آن قطر میدان روشن را روی آماده سازی تعیین می کند. آینه نور را از روشن کننده به کندانسور هدایت می کند. برای حفظ موازی پرتوهایی که از روشن کننده به کندانسور می آیند، لازم است فقط از سمت صاف آینه استفاده شود.
تنظیم نور و فوکوس میکروسکوپ
کیفیت تصویر نیز تا حد زیادی به نور مناسب بستگی دارد. چندین روش مختلف برای روشن کردن یک نمونه در زیر میکروسکوپ وجود دارد. رایج ترین راه این است تاسیسات روشنایی بر اساس کوهلر، که به شرح زیر است:
1) روشن کننده را در مقابل آینه میکروسکوپ قرار دهید.
2) لامپ روشن کننده را روشن کنید و نور را روی یک آینه میکروسکوپ تخت (!) هدایت کنید.
3) آماده سازی را روی مرحله میکروسکوپ قرار دهید.
4) آینه میکروسکوپ را با یک تکه کاغذ سفید بپوشانید و با حرکت دادن سوکت لامپ در روشن کننده، تصویر رشته لامپ را روی آن متمرکز کنید.
5) یک ورق کاغذ را از آینه بردارید.
6) دیافراگم دیافراگم کندانسور را ببندید. با حرکت آینه و حرکت کمی سوکت لامپ، تصویر رشته بر روی دیافراگم دیافراگم متمرکز می شود. فاصله روشن کننده از میکروسکوپ باید به گونه ای باشد که تصویر رشته لامپ برابر با قطر دیافراگم دیافراگم کندانسور باشد (دیافراگم دیافراگم را می توان با استفاده از یک آینه تخت که در سمت راست پایه میکروسکوپ قرار داده شده است مشاهده کرد. ).
7) دیافراگم دیافراگم کندانسور را باز کنید ، باز شدن دیافراگم میدان روشنگر را کاهش دهید و به میزان قابل توجهی تابش لامپ را کاهش دهید.
8) با بزرگنمایی کم (10x)، با نگاه کردن به چشمی، تصویر واضحی از آماده سازی به دست می آید.
9) با کمی چرخاندن آینه، تصویر دیافراگم میدان که مانند یک نقطه روشن به نظر می رسد، به مرکز میدان دید منتقل می شود. با پایین آوردن و بالا بردن کندانسور، تصویر واضحی از لبه های دیافراگم میدان در صفحه آماده سازی به دست می آید (حاشیه رنگی در اطراف آنها دیده می شود).
10) دیافراگم میدان روشنگر را به لبه های میدان دید باز کنید ، تابش رشته لامپ را افزایش دهید و کمی (1/3) باز شدن دیافراگم دیافراگم کندانسور را کاهش دهید.
11) هنگام تعویض لنز، باید تنظیمات نور را بررسی کنید.
پس از تکمیل تنظیم نور طبق کوهلر، تغییر موقعیت کندانسور و باز شدن میدان و دیافراگم دیافراگم غیرممکن است. روشنایی آماده سازی را فقط می توان با فیلترهای نور خنثی یا با تغییر رشته لامپ با استفاده از رئوستات تنظیم کرد. باز شدن بیش از حد دیافراگم دیافراگم کندانسور می تواند منجر به کاهش قابل توجه کنتراست تصویر شود و باز نشدن کافی می تواند منجر به بدتر شدن قابل توجه کیفیت تصویر (ظاهر حلقه های پراش) شود. برای بررسی باز شدن صحیح دیافراگم دیافراگم، لازم است چشمی را برداشته و با نگاه کردن به لوله، آن را باز کنید تا یک سوم میدان نوری را بپوشاند. برای روشنایی صحیح آماده سازی، هنگام کار با لنزهای با بزرگنمایی کم (تا 10 برابر)، باید عدسی بالایی کندانسور را باز کرده و خارج کنید.
توجه! هنگام کار با لنزهایی که بزرگنمایی بالایی دارند - با سیستم های خشک قوی (40x) و غوطه وری (90x) برای آسیب نرساندن به لنز جلویی، هنگام فوکوس از تکنیک زیر استفاده می شود: مشاهده از کنار، لنز را با ماکرو پایین بیاورید. تقریباً تا زمانی که با آماده سازی تماس پیدا کند، پیچ کنید، سپس با نگاه کردن به چشمی، ماکرو اسکرو بسیار آهسته لنز را بالا می برد تا تصویر ظاهر شود و با کمک میکروسکوپ فوکوس نهایی میکروسکوپ انجام می شود.
مراقبت از میکروسکوپ
هنگام کار با میکروسکوپ، از تلاش زیاد استفاده نکنید. سطوح لنزها، آینه ها و فیلترها را با انگشتان خود لمس نکنید.
برای محافظت از سطوح داخلی اهداف و همچنین منشورهای لوله در برابر گرد و غبار، همیشه باید چشمی را در لوله بگذارید. هنگام تمیز کردن سطوح خارجی لنزها، گرد و غبار را با یک برس نرم شسته شده در اتر از روی آنها پاک کنید. در صورت لزوم، سطوح لنز را با یک پارچه کتانی یا کامبریک خوب شسته شده و بدون صابون که کمی با بنزین تمیز، اتر یا مخلوط مخصوص برای تمیز کردن اپتیک مرطوب شده است، به دقت پاک کنید. توصیه نمی شود اپتیک لنز را با زایلن پاک کنید، زیرا ممکن است باعث چسبندگی آنها شود.
از آینههایی با نقرهکاری خارجی، فقط میتوانید گرد و غبار را با دمیدن با لامپ لاستیکی پاک کنید. شما نمی توانید آنها را پاک کنید. همچنین غیرممکن است که خودتان لنزها را باز کرده و جدا کنید - این منجر به آسیب آنها می شود. پس از اتمام کار بر روی میکروسکوپ، لازم است به روشی که در بالا توضیح داده شد، بقایای روغن غوطه وری را از عدسی جلوی شیء جدا کنید. سپس استیج (یا کندانسور در میکروسکوپ های دارای مرحله ثابت) را پایین بیاورید و روی میکروسکوپ را با پوشش بپوشانید.
برای حفظ ظاهر میکروسکوپ، لازم است به طور دوره ای آن را با یک پارچه نرم که کمی آغشته به وازلین بدون اسید است و سپس با یک پارچه خشک، نرم و تمیز پاک کنید.
علاوه بر میکروسکوپ نوری معمولی، روشهای میکروسکوپی وجود دارد که به شما امکان میدهد میکروارگانیسمهای رنگآمیزی را مطالعه کنید: کنتراست فاز , تاریک فیلدو شب تابمیکروسکوپ برای مطالعه میکروارگانیسم ها و ساختار آنها که اندازه آنها کمتر از وضوح میکروسکوپ نوری است، استفاده کنید.
میکروسکوپ نوری
میکروسکوپ نوری، ابزار اصلی زیست شناسی، یک سیستم نوری است که از یک خازن و یک شیئی تشکیل شده است. پرتو نور از منبع نور در یک کندانسور جمع آوری شده و به سمت جسم هدایت می شود (شکل 1). پس از عبور از جسم، پرتوهای نور وارد سیستم عدسی شیء می شوند. آنها تصویر اولیه را می سازند که توسط عدسی چشمی بزرگ می شود. بخش نوری اصلی میکروسکوپ که قابلیت های اصلی آن را مشخص می کند، عدسی است. در میکروسکوپ های مدرن، عدسی ها قابل تعویض هستند که به شما امکان می دهد سلول ها را با بزرگنمایی های مختلف مطالعه کنید. ویژگی اصلی یک میکروسکوپ به عنوان یک سیستم نوری قدرت تفکیک آن است. تصاویر ارائه شده توسط لنز را می توان با استفاده از یک چشمی قوی یا مثلاً با نمایش بر روی صفحه نمایش (حداکثر 105 بار) بزرگنمایی کرد. محاسبه می شود که وضوح لنز، یعنی. حداقل فاصله بین دو نقطه که به طور جداگانه قابل مشاهده هستند برابر خواهد بود
جایی که؟ طول موج نوری است که برای روشن کردن جسم استفاده می شود. n ضریب شکست محیط است. ? - زاویه بین محور نوری عدسی و منحرف ترین پرتو ورودی به لنز. وضوح یک میکروسکوپ به طول موج بستگی دارد - هر چه کوچکتر باشد، جزئیات کوچکتر را می توانیم ببینیم، و به دیافراگم عددی شی (n sin ?) - هر چه بیشتر باشد، وضوح بالاتر است. به طور معمول، میکروسکوپ های نوری از منابع نور در ناحیه مرئی طیف (400-700 نانومتر) استفاده می کنند، بنابراین حداکثر وضوح میکروسکوپ در این مورد ممکن است بیشتر از 200-350 نانومتر (0.2-0.35 میکرون) نباشد. اگر از نور فرابنفش (260-280 نانومتر) استفاده شود، وضوح را می توان به 130-140 نانومتر (0.13-0.14 میکرومتر) افزایش داد. این حد وضوح نظری میکروسکوپ نوری خواهد بود که توسط ماهیت موجی نور تعیین می شود. بنابراین، تنها چیزی که یک میکروسکوپ نوری می تواند به عنوان یک وسیله کمکی به چشم ما بدهد این است که قدرت تفکیک آن را حدود 1000 برابر افزایش دهد (چشم غیرمسلح انسان قدرت تفکیک دارد.
ظرفیت حدود 0.1 میلی متر است که برابر با 100 میکرون است). این بزرگنمایی "مفید" میکروسکوپ است که در بالای آن فقط خطوط تصویر را بدون فاش کردن جزئیات جدید در آن افزایش خواهیم داد. بنابراین، هنگام استفاده از ناحیه مرئی نور، 0.2-0.3 میکرومتر حد تفکیک نهایی میکروسکوپ نوری است.
اما همچنان در یک میکروسکوپ نوری، ذرات کوچکتر از 0.2 میکرون دیده می شود. این روش "میدان تاریک" یا همانطور که قبلاً به آن روش "اولترامیکروسکوپی" می گفتند. ماهیت آن این است که مانند ذرات گرد و غبار در یک پرتو نور (اثر Tyndall)، ذرات ریز (کمتر از 0.2 میکرون) در یک سلول تحت نور جانبی می درخشند، نور منعکس شده از آن وارد عدسی میکروسکوپ می شود. این روش با موفقیت در مطالعه سلول های زنده مورد استفاده قرار گرفته است.
اگر سلول های زنده یا مرده درمان نشده در نور عبوری مشاهده شوند، به دلیل داشتن ضریب شکست و جذب پرتوهای نور متفاوت از محیط، تنها جزئیات بزرگ در آنها متمایز می شود. بزرگ
برخی از اجزای سلولی از نظر این ویژگی ها هم از محیط (محلول های آب یا بافت) و هم از یکدیگر تفاوت کمی دارند و بنابراین به سختی قابل توجه هستند و متضاد نیستند. برای مطالعه آنها، باید نور را تغییر داد (در حالی که وضوح تصویر را از دست داد) یا روش ها و دستگاه های خاصی را اعمال کرد. یکی از این روش ها میکروسکوپ فاز کنتراست است که به طور گسترده ای برای مشاهده سلول های زنده استفاده می شود. این بر این واقعیت استوار است که بخش های جداگانه یک سلول به طور کلی شفاف، اگرچه اندکی، اما همچنان از نظر چگالی و شکست نور با یکدیگر متفاوت هستند. با عبور از آنها، نور فاز خود را تغییر می دهد، اما چشم ما چنین تغییری را در فاز موج نور نمی بیند، زیرا فقط به تغییرات شدت نور حساس است. دومی به دامنه موج نور بستگی دارد. در یک میکروسکوپ کنتراست فاز، یک صفحه ویژه در لنز نصب شده است که از آن عبور می کند که پرتو نور یک تغییر فاز اضافی از نوسانات را تجربه می کند. هنگام ساخت یک تصویر، پرتوهایی که از قبل در حال تعامل هستند
در یک فاز یا در آنتی فاز، اما با دامنه های مختلف. این یک تصویر کنتراست روشن و تاریک از جسم ایجاد می کند.
تکنیک مشابهی در میکروسکوپ تداخلی استفاده می شود. به گونه ای طراحی شده است که پرتوی از پرتوهای نور موازی از روشنگر به دو جریان تقسیم می شود. یکی از آنها از جسم عبور می کند و در فاز نوسان تغییراتی به دست می آورد، دیگری از شیء دور می زند. در منشورهای هدف، هر دو جریان دوباره به هم متصل می شوند و با یکدیگر تداخل می کنند. در نتیجه تداخل، تصویری ساخته می شود که بر روی آن بخش هایی از سلول با ضخامت های مختلف یا چگالی متفاوت از نظر کنتراست با یکدیگر متفاوت خواهند بود. در این دستگاه با اندازه گیری تغییر فاز می توان غلظت و جرم ماده خشک موجود در جسم را تعیین کرد.
با کمک یک میکروسکوپ پلاریزه، اجسامی که به اصطلاح ایزوتروپی دارند، یعنی. جهت گیری منظم ذرات زیر میکروسکوپی (به عنوان مثال، فیبرهای دوک شکافت، میوفیبریل ها و غیره). در چنین میکروسکوپی، در مقابل کندانسور
یک پلارایزر قرار داده شده است که امواج نور را با یک صفحه قطبش مشخص منتقل می کند. پس از آماده سازی و لنز، یک آنالایزر قرار می گیرد که می تواند نور را با همان صفحه قطبش منتقل کند. پلاریزه کننده و آنالایزر منشورهایی هستند که از اسپار ایسلندی (منشورهای نیکول) ساخته شده اند. اگر منشور دوم (آنالایزر) نسبت به منشور اول 90 درجه بچرخد، نوری از آن عبور نخواهد کرد. در موردی که بین چنین منشورهای متقاطع جسمی با انکسار مضاعف وجود دارد، یعنی. توانایی قطبش نور، در یک میدان تاریک می درخشد. با استفاده از یک میکروسکوپ پلاریزه، می توان به عنوان مثال، آرایش جهت دار میسل ها را در دیواره سلولی گیاه بررسی کرد.
مطالعه حیاتی (در طول عمر) سلول ها
یک میکروسکوپ نوری به شما امکان می دهد سلول های زنده را ببینید. برای مشاهده کوتاه مدت، سلول ها به سادگی در یک محیط مایع روی یک لام شیشه ای قرار می گیرند. اگر به مشاهده طولانی مدت سلول ها نیاز دارید، پس
از دوربین های مخصوص استفاده می شود. اینها یا بطریهای مسطح با سوراخهایی هستند که با شیشههای نازک پوشیده شدهاند یا اتاقهای تخت تاشو. به عنوان اشیا، میتوان از سلولهای زنده آزاد تک یاختهها و دیگر موجودات تک سلولی، سلولهای خونی یا سلولهای بافتی جداشده ارگانیسمهای چند سلولی با منشأ حیوانی و گیاهی استفاده کرد. در هر یک از این موارد، سلول ها در محیط های مخصوص انتخاب شده مورد مطالعه قرار می گیرند. موجودات تک سلولی آزاد در همان محیط هایی که در شرایط طبیعی زندگی می کنند و یا در آزمایشگاه کشت می شوند مورد بررسی و مطالعه قرار می گیرند. بنابراین، برای برخی از تک یاخته ها، محیط های مصنوعی ایجاد شده است که در آن رشد و تکثیر می شوند. معمولاً اینها محلولهای نمکی متعادل با افزودن میکروارگانیسمها یا سایر تک یاخته ها هستند که به عنوان غذا برای این نوع ارگانیسم ها عمل می کنند.
سلول های خونی یا سایر سلول های آزاد موجودات چند سلولی را می توان در قطره پلاسما یا در محیط های مصنوعی خاص مطالعه کرد.
برای مطالعه سلول های اندام ها و بافت های حیوانات،
روش کشت سلولی یک نسخه ساده تر از این روش این است که یک قطعه کوچک از بافت زنده در یک محفظه پر از یک محیط غذایی (مخلوطی از پلاسمای خون با عصاره جنینی یا مخلوطی از یک محیط مصنوعی با افزودن پلاسمای خون) قرار می گیرد. پس از مدتی تقسیم و رشد سلولی در حاشیه چنین قطعه ای آغاز می شود. در مورد دیگر، قطعه بریده شده از بافت به آرامی با محلولی از آنزیم تریپسین یا هلاتون - ورسن درمان می شود، که منجر به جدا شدن آن، به جدا شدن کامل سلول ها از یکدیگر می شود. سپس، چنین سوسپانسیونی از سلول های شسته شده در ظرفی با یک محیط غذایی قرار داده می شود، جایی که آنها به پایین فرو می روند، به شیشه می چسبند و شروع به تکثیر می کنند، ابتدا کلنی ها و سپس یک لایه سلولی پیوسته تشکیل می دهند. به این ترتیب کشت های سلولی تک لایه رشد می کنند که برای مشاهدات درون تنی بسیار راحت هستند. بهتر است از مواد جنینی برای به دست آوردن کشت های اولیه از بافت های حیوانی استفاده شود. کشت از سلول های موجودات بالغ رشد بسیار ضعیفی دارد.
هنگام پرورش سلول های خارج از بدن، علاوه بر تغییر محیط، حفظ دمای مورد نیاز (حدود 20 درجه برای خونسردها و حدود 37 درجه برای خون گرم) مهم است. شرط لازم برای کشت سلولی، عقیمی است. تعدادی سلول کشت طولانی مدت وجود دارد. اینها گونه های سلولی خاصی هستند که برای چندین دهه با رشد خارج از بدن سازگار شده اند. در بیشتر موارد، اینها سلول هایی با منشاء تومور یا سلول های تغییر یافته قابل توجهی هستند که خواص سلول های تومور را به دست آورده اند.
در حال حاضر روش کشت سلول های خارج از بدن نه تنها برای سیتولوژی، بلکه برای مطالعات ژنتیکی، ویروس شناسی و بیوشیمیایی به طور گسترده مورد استفاده قرار می گیرد.
سلول های گیاهی را می توان در محیط کشت نیز رشد داد. برای انجام این کار، قطعات بافت با آنزیم هایی که غشای سلولی را حل می کنند، درمان می شوند. اجسام سلولی جدا شده، پروتوپلاست ها، در محیط کشت قرار می گیرند و در آنجا تقسیم می شوند و مناطقی از سلول های تکثیر شده را تشکیل می دهند.
مشاهدات روی سلول های زنده معمولاً به عنوان ثبت می شوند
عکس هایی که با ضمیمه های میکروسکوپ مخصوص گرفته شده اند. از سلول های زنده نیز می توان فیلمبرداری کرد. در برخی موارد، چنین میکروفیلمی اطلاعات بسیار مهمی را ارائه می دهد. با استفاده از فیلمبرداری تسریع شده یا حرکت آهسته (فیلمبرداری تایم لپس)، می توان روند فرآیندهای مهمی مانند تقسیم سلولی، فاگوسیتوز، جریان سیتوپلاسم، ضربان مژک و غیره را با جزئیات مشاهده کرد.
اکنون با پیشرفت فناوری کامپیوتری، با کمک دوربین های تلویزیونی خاص، می توان تصویری از سلول ها را مستقیماً بر روی مانیتور رایانه به دست آورد، آنها را در حافظه رایانه ثبت کرد، آنها را به هر شکل ممکن پردازش کرد و چاپ های رنگی دریافت کرد. یا چاپگرهای سیاه و سفید همچنین می توان از چنین تجهیزات ویدئویی کامپیوتری برای عکسبرداری تایم لپس از اجسام متحرک استفاده کرد.
در مطالعه سلول های زنده از روش های میکروسرجری و مداخله جراحی روی سلول ها استفاده می شود. با کمک دستگاه میکرومانیپولاتور، سلول ها بریده می شوند، قسمت هایی از آنها جدا می شود، مواد تزریق می شوند (میکرواینجکشن) و .... micromanipulator با یک معمولی ترکیب شده است
میکروسکوپی که در آن پیشرفت عمل مشاهده می شود. ابزار جراحی میکروسکوپی عبارتند از قلاب های شیشه ای، سوزن ها، مویرگ ها، که دارای ابعاد میکروسکوپی هستند و بر روی دستگاه های ویژه - "میکروفرج" ساخته می شوند. در حین ریزمانیپولاسیون، سلول ها در محفظه های مخصوصی قرار می گیرند که ابزارها نیز در آن قرار می گیرند. بنابراین، با کمک یک میکرومانیپولاتور، میتوان هستهها را از یک سویه آمیب به دیگری پیوند داد و ثابت کرد که این هسته سلول است که ویژگیهای فیزیولوژیکی سلول را به عنوان یک کل تعیین میکند. با کمک یک میکرومانیپولاتور میتوان طلای کلوئیدی را به سلول آمیب تزریق کرد و سپس توزیع ذرات آن را در سیتوپلاسم و هسته مطالعه کرد.
با کمک چنین ابزارهای میکروسکوپی، می توان دوک های میتوزی را در سلول ها چرخاند، کروموزوم های منفرد را بیرون کشید و آنتی بادی های برچسب دار یا مولکول های پروتئینی مختلف را به یک سلول زنده وارد کرد. علاوه بر اثر مکانیکی بر روی سلول ها در میکروسرجری، اخیراً میکروپرتوهای فرابنفش به طور گسترده ای مورد استفاده قرار گرفته اند.
میکروپرتوهای نور یا لیزر این امکان را فراهم می کند که تقریباً بلافاصله بخش های جداگانه یک سلول زنده غیرفعال شود. بنابراین، برای مثال، می توان یکی از هسته ها را غیرفعال کرد و سرنوشت هسته دوم، سالم را دنبال کرد. در این مورد، نشان داده شده است که هسته دوم بار اضافی را می گیرد و "برای دو کار می کند". با کمک ریزپرتوها می توان به قسمتی از کروموزوم میتوزی یا بخشی از دوک تقسیم کننده برخورد کرد. معلوم شد که آسیب به سانترومر کروموزوم، کروموزوم دوم را از روند واگرایی کروموزوم ها به قطب های سلول در طول میتوز خارج می کند. اخیراً از دستگاه هایی با میکروپرتو لیزر استفاده شده است که امکان دوز بسیار دقیق مقدار انرژی در نقطه آسیب و استفاده از پالس های تابشی بسیار کوتاه (نان ثانیه) را ممکن می سازد.
هنگام مطالعه سلول های زنده سعی می کنند با کمک رنگ های به اصطلاح حیاتی آنها را رنگ آمیزی کنند. اینها رنگهایی با طبیعت اسیدی (تریپان آبی، لیتیوم کارمین) هستند که در رقت بسیار زیاد (1: 200000) استفاده می شوند، بنابراین،
تأثیر رنگ بر فعالیت حیاتی سلول حداقل است. هنگام رنگ آمیزی سلول های زنده، رنگ در سیتوپلاسم به صورت گرانول جمع آوری می شود، در حالی که در سلول های آسیب دیده یا مرده، رنگ آمیزی منتشر سیتوپلاسم و هسته رخ می دهد.
در مطالعه سلول های زنده از رنگ های فلورسنت و میکروسکوپ فلورسانس به طور گسترده استفاده می شود. ماهیت آن در این واقعیت نهفته است که تعدادی از مواد هنگام جذب انرژی نور، توانایی درخشش (فلورسانس، لومینسانس) را دارند. طیف فلورسانس با توجه به تشعشعی که فلورسانس را تحریک می کند، همیشه به سمت طول موج های طولانی تر تغییر می کند. بنابراین، به عنوان مثال، کلروفیل جدا شده هنگامی که در پرتوهای فرابنفش روشن می شود، قرمز می درخشد. این اصل در میکروسکوپ فلورسانس استفاده می شود: مشاهده اجسام فلورسنت در منطقه طول موج کوتاه. به طور معمول، چنین میکروسکوپ هایی از فیلترهایی استفاده می کنند که در ناحیه آبی-بنفش روشنایی ایجاد می کنند. میکروسکوپ های فلورسنت فرابنفش وجود دارد.
برخی از رنگدانه ها (کلروفیل ها، رنگدانه های باکتریایی)، ویتامین ها (A و B2)، هورمون ها فلورسانس خاص خود را دارند. اگر سلول های گیاهی را با میکروسکوپ فلورسنت بررسی کنیم، در پس زمینه آبی تیره، دانه های قرمز درخشان در داخل سلول قابل مشاهده خواهند بود - اینها کلروپلاست هستند.
میکروسکوپ فلورسانس را می توان با افزودن فلوئوروکروم (مواد فلورسنت) به سلول های زنده استفاده کرد. این روش شبیه رنگآمیزی حیاتی است زیرا از غلظتهای بسیار کم رنگ (1*10-4-1*10-5) در اینجا نیز استفاده میشود. بسیاری از فلوئوروکروم ها به طور انتخابی به ساختارهای سلولی خاصی متصل می شوند و باعث درخشندگی ثانویه آنها می شوند. به عنوان مثال، فلوروکروم آکریدین نارنجی به طور انتخابی به اسیدهای نوکلئیک متصل می شود. علاوه بر این، هنگام اتصال به شکل مونومر با DNA، به رنگ سبز فلورسانس می شود و در شکل دیمری با RNA به رنگ قرمز می درخشد. با مشاهده سلول های زنده رنگ آمیزی شده با پرتقال آکریدین، مشخص می شود که هسته آنها دارای درخشش سبز و سیتوپلاسم است.
و هسته ها قرمز می درخشند. بنابراین، در یک سلول زنده، با استفاده از این روش، می توان محلی سازی (و در برخی موارد مقدار) برخی از مواد شیمیایی را مشاهده کرد. فلوروکروم هایی وجود دارند که به طور انتخابی به لیپیدها، موکوس، کراتین و غیره متصل می شوند.
آنتی بادی های نشاندار شده با فلوروکروم نیز می توانند به سلول های زنده تزریق شوند. برای مثال، آنتیبادیهای متصل به فلوروکروم به پروتئین توبولین وارد شده به سلول به میکروتوبولها متصل میشوند، که اکنون میتوان آنها را در سلولهای زنده با میکروسکوپ فلورسنت مشاهده کرد.
اخیراً ترکیبی از میکروسکوپ نوری (مخصوصاً فاز کنتراست) با پردازش تصویر الکترونیکی-رایانه ای به طور گسترده برای مطالعه سلول های زنده یا اجزای آنها استفاده می شود. در این مورد، یک فیلم ضبط شده با پردازش تصویر الکترونیکی استفاده می شود که، همانطور که بود، سطوح پس زمینه را "حذف" می کند و ساختارهای مشاهده شده را برجسته و متضاد می کند. این تکنیک به شما امکان می دهد چنین ساختارهایی را روی صفحه تلویزیون ببینید.
به عنوان میکروتوبول هایی که اندازه آنها (20 نانومتر) بسیار کوچکتر از قدرت تفکیک میکروسکوپ نوری است. استفاده از چنین سیستم هایی نه تنها جایگزین فیلمبرداری تایم لپس می شود، به جای آن از ضبط ویدئو استفاده می شود، بلکه امکان پردازش کامپیوتری تصویر را نیز فراهم می کند: اطلاعاتی در مورد چگالی سازه ها، پارامترهای آنها، تعداد و سازماندهی سه بعدی. در ترکیب با میکروسکوپ فلورسانس، این روشها چشمانداز بزرگی را در مطالعه سلولهای زنده باز میکنند.
استفاده از روش های مرسوم میکروسکوپ نوری برای بازتولید یک تصویر سه بعدی از جسم مورد مطالعه به دلیل عمق میدان کوچک میکروسکوپ دشوار است. سلول ها معمولاً به عنوان بخش های نوری در عمق مشخصی از فوکوس مشاهده می شوند. برای به دست آوردن یک بازسازی کامل سه بعدی از جسم، از میکروسکوپ نوری اسکن کانفوکال ویژه استفاده می شود. به کمک این دستگاه یک سری مقاطع اپتیکی متوالی به دست می آید که از اعماق مختلف گرفته شده و تصاویر آن در کامپیوتر انباشته شده و طبق یک خاص
این برنامه یک تصویر سه بعدی و سه بعدی از یک شی را بازسازی می کند. به طور معمول، اشیاء رنگ آمیزی شده با فلوروکروم استفاده می شود.
مطالعه سلول های ثابت
با وجود اهمیت و سادگی مشاهدات حیاتی، بیشتر اطلاعات در مورد ساختار و خواص سلول ها با استفاده از مواد ثابت به دست آمده است. اگر سلول آسیب ببیند، شروع به یک سری تغییرات می کند و پس از مرگ سلول، آنزیم های اتولیتیک در آن فعال می شوند که منجر به تغییرات فاحش در ساختار سلولی می شود. بنابراین، وظایف تثبیت، از بین بردن سلول، توقف فعالیت آنزیم های درون سلولی، جلوگیری از پوسیدگی اجزای سلولی و همچنین جلوگیری از از بین رفتن ساختارها و مواد و جلوگیری از ظهور ساختارهایی است که در یک سلول زنده وجود ندارند. سازه های مصنوع). متأسفانه، هنوز هیچ تثبیت کننده شیمیایی یافت نشده است که تمام این الزامات را برآورده کند.
آلدهیدها و مخلوط آنها با سایر مواد اغلب برای تثبیت استفاده می شود. الکل ها نیز به عنوان تثبیت کننده استفاده می شوند.
باعث دناتوره شدن غیر قابل برگشت پروتئین ها، رسوب اسیدهای نوکلئیک و پلی ساکاریدها می شود. فیکساتورهای سابلیمیت و فیکساتورها با اسید پیکریک اثر رسوب دهندگی دارند. فیکساتورهای حاوی تتروکسید اسمیم (OsO4) لیپیدها را به خوبی حفظ می کنند.
پس از تعمیر، اشیاء می توانند در آینده تحت پردازش اضافی قرار گیرند. یکی از اصلی ترین این درمان ها رنگ آمیزی سلولی است. این رنگ آمیزی اضافی سلول ها بود که باعث شد جزئیات زیادی در آنها آشکار شود.
اسلایدهایی با اسمیر ثابت ارگانیسم های تک سلولی یا با سلول های کشت بافت را می توان مستقیماً در لکه ها قرار داد. اما برای رنگ آمیزی سلول ها در ترکیب اندام ها، لازم است بخش های آنها به دست آید. چنین بخش ها و سلول های فردی مورد مطالعه قرار می گیرند.
برای انجام این کار، پس از تثبیت، قطعات اندام در الکل هایی با غلظت فزاینده آبگیری می شوند، الکل با زایلن و زایلن با پارافین جایگزین می شود. بنابراین، بافت ثابت، با دور زدن خشک شدن هوا، در یک توده جامد از پارافین محصور می شود که می تواند بریده شود.
بخش هایی با ضخامت 5-10 میکرون بر روی یک دستگاه خاص - میکروتوم به دست می آیند. چنین بخش هایی به یک اسلاید شیشه ای چسبانده می شوند: پارافین در زایلن حل می شود، زایلن با الکل ها حذف می شود که با آب جایگزین می شوند. اکنون می توان بخش ها را با محلول های آبی رنگ آمیزی رنگ آمیزی کرد. برای تهیه آمادهسازی دائمی، قسمتهای رنگآمیزی مجدداً آبگیری میشوند و در بلسان کانادایی زیر یک لپه قرار میگیرند؛ این مواد را میتوان برای مدت طولانی نگهداری کرد.
برای رنگ آمیزی بافت ها و سلول های ثابت از رنگ های طبیعی و عمدتاً مصنوعی استفاده می شود. رنگهای طبیعی (هماتوکسیلین، کارمین، و غیره) در ترکیب با مواد (اکسیدهای فلزات مختلف) استفاده می شود که با آنها ترکیبات پیچیده (لاک) تشکیل می دهند.
رنگ های مصنوعی به دو دسته اسیدی و بازی تقسیم می شوند. رنگ های پایه نمک های پایه های رنگی حاوی گروه های آمینه در ترکیب خود هستند که خاصیت قلیایی آنها را تعیین می کنند. این رنگها با نمک پیوند تشکیل می دهند
گروه های اسیدی در ساختار سلولی در نتیجه، مناطقی از سلولهای غنی از گروههای اسیدی به رنگهای بازی متصل میشوند، همانطور که به آنها بازوفیل میگویند. رنگ های اسیدی حاوی گروه های هیدروکسیل یا گروه های SO2OH هستند. ساختارهای سلولی با خواص بازی (قلیایی) به رنگهای اسیدی متصل میشوند و اسیدو یا اکسیفیل نامیده میشوند. مخلوط های زیادی از این گونه رنگ ها وجود دارد که می تواند به طور همزمان قسمت های مختلف سلول ها را به رنگ های مختلف رنگ آمیزی کند و در نتیجه کنتراست اجزای سلولی و خارج سلولی را افزایش دهد. بنابراین، با استفاده از رنگ های مختلف، محققان نه تنها به یک تصویر مورفولوژیکی واضح از سلول دست می یابند، بلکه اطلاعاتی در مورد شیمی یک ساختار خاص نیز به دست می آورند.
تعدادی از تکنیک های رنگارنگ با هدف شناسایی مواد شیمیایی خاص، هیستوشیمیایی و سیتوشیمیایی نامیده می شوند. روش های زیادی برای تجزیه و تحلیل سیتوشیمیایی وجود دارد.
تعدادی از تکنیک های رنگارنگ خاص، به طور مستقیم وجود دارد
تشخیص مواد خاص اینها در واقع واکنش های هیستوشیمیایی (سیتوشیمیایی) هستند. الزامات اصلی برای چنین واکنش هایی به شرح زیر است: ویژگی اتصال رنگ، تغییر ناپذیری محلی سازی ماده.
نمونه ای از این نوع واکنش های سیتوشیمیایی می تواند یک واکنش پرکاربرد برای DNA، واکنش Feulgen باشد (شکل 8). ماهیت آن این است که پس از هیدرولیز اسید خاص فقط روی DNA، در نتیجه برش پورین ها روی دئوکسی ریبوز، گروه های آلدئیدی تشکیل می شوند. این گروهها میتوانند با یک نشانگر خاص، معرف شیف (پایه فوشسین تغییر رنگیافته) واکنش نشان دهند، که باعث ایجاد رنگآمیزی قرمز در محلهای محلیسازی DNA میشود. اتصال رنگ در این مورد کاملاً کمی است، که نه تنها به شناسایی و نشان دادن مکان هایی که DNA وجود دارد، بلکه امکان اندازه گیری مقدار آن را نیز می دهد. با استفاده از همان اصل شناسایی گروه های آلدهیدی، می توان محل پلی ساکاریدها را در سلول ها پس از هیدرولیز آنها با اسید پریودیک (به اصطلاح واکنش PAS) مشاهده کرد.
همچنین می توان به طور خاص محل پروتئین ها را با واکنش به اسیدهای آمینه فردی (تیروزین، تریپتوفان، آرژنین و غیره) تعیین کرد. لیپیدها و چربیها در سلولهایی با رنگهای مخصوص (سودان سیاه) شناسایی میشوند که به خوبی حل میشوند و در آخالهای چربی تجمع مییابند.
یک گروه کامل از واکنش های سیتوشیمیایی با تشخیص آنزیم ها همراه است. اصل کلی این واکنش ها این است که این خود آنزیم های پروتئینی نیستند که در زیر میکروسکوپ قابل مشاهده هستند، بلکه مکان های محلی سازی آنها هستند که توسط محصولات فعالیت آنزیمی خاص آنها تشخیص داده می شود.
مقدار محصول نهایی واکنش سیتوشیمیایی را می توان با استفاده از روش سیتوفتومتری تعیین کرد. این بر اساس تعیین مقدار مواد شیمیایی با جذب نور با طول موج مشخص است. مشخص شد که شدت جذب پرتوها با غلظت ماده در همان ضخامت جسم متناسب است. بنابراین با تخمین میزان جذب نور توسط یک ماده معین می توان به میزان آن پی برد. برای این نوع تحقیقات،
دستگاه ها - میکروسکوپ-سیتوفتومتر؛ آنها یک فتومتر حساس در پشت عدسی دارند که شدت شار نوری را که از جسم عبور می کند را ثبت می کند. با دانستن مساحت یا حجم ساختار اندازه گیری شده و مقدار جذب، می توان هم غلظت یک ماده و هم محتوای مطلق آن را تعیین کرد. روش سیتوفتومتری به طور گسترده در تعیین مقدار DNA در هر سلول پس از واکنش Feulgen استفاده می شود. در این مورد، این خود DNA نیست که نورسنجی می شود، بلکه محتوای فوشین قرمز رنگ است که مقدار آن با محتوای DNA نسبت مستقیم دارد. با مقایسه مقادیر جذب بهدستآمده با استانداردها، میتوان مقادیر دقیقی از مقدار DNA را به صورت گرم به دست آورد. این روش امکان اندازه گیری مقدار DNA را تا 10-12 - 10-14 گرم می دهد، در حالی که روش های میکروشیمیایی حساسیتی بیش از 10-6 گرم ندارند. با کمک سیتوفتومتری، محتوای DNA در سلول ها با دقت بسیار بیشتری تعیین می شود. نسبت به روش های بیوشیمیایی مرسوم
نه تنها جذب نور
اشیاء و مواد، بلکه تابش (درخشنده). بنابراین، روشهای فلورومتری کمی ایجاد شدهاند که تعیین محتوای موادی را که فلوئوروکرومها با درجه لومینسانس به آنها متصل میشوند، ممکن میسازد.
برای شناسایی پروتئین های خاص، از واکنش های ایمونوشیمیایی با استفاده از آنتی بادی های فلورسنت استفاده می شود. این روش ایمونوفلورسانس دارای ویژگی و حساسیت بسیار بالایی است. میتوان از آن برای شناسایی نه تنها پروتئینها، بلکه توالیهای نوکلئوتیدی منفرد در DNA یا تعیین محلیسازی مولکولهای هیبریدی RNA-DNA استفاده کرد. برای انجام این کار، ابتدا سرم های اختصاصی حاوی آنتی بادی برای یک پروتئین (مثلاً توبولین) به دست می آید. آنتی بادی های خالص شده از نظر شیمیایی با فلوروکروم ها جفت می شوند. چنین آمادهسازیهایی روی اجسام ریخته میشوند و با استفاده از یک میکروسکوپ فلورسنت، مکانهای پروتئین مورد نظر در سلول توسط فلورسانس فلوئوروکروم پیدا میشود. با این حال، برای اینکه آنتی بادی های نشاندار شده با فلوئوروکروم وارد سلول شوند، غشای پلاسمایی لازم است.
آن را قابل نفوذ کند. این معمولاً با تثبیت سلولی و استخراج جزئی لیپیدها از غشاها به دست می آید. برای مطالعه پروتئین های اسکلت سلولی با استفاده از این روش، فرد به انحلال غشای سلولی با مواد شوینده مختلف متوسل می شود.
برای تعیین محلی سازی مکان ها برای سنتز پلیمرهای زیستی، برای تعیین مسیرهای انتقال مواد در سلول، برای نظارت بر مهاجرت یا خواص سلول های فردی، روش اتورادیوگرافی به طور گسترده ای استفاده می شود - ثبت مواد برچسب گذاری شده با ایزوتوپ ها. (شکل 9). اصل این روش بسیار ساده است، روش بکرل را تکرار می کند که واپاشی رادیواکتیو را کشف کرد. در طول بررسی رادیوآوتوگرافی، سلول ها با پیش ساز یکی از ترکیبات ماکرومولکولی (به عنوان مثال، اسید آمینه یا نوکلئوتید)، که یکی از اتم های آن با یک ایزوتوپ رادیواکتیو جایگزین می شود، وارد محیط می شوند. به عنوان مثال، به جای 12C، یک اتم 14C، به جای هیدروژن، تریتیوم 3H و غیره وارد می شود. در فرآیند سنتز، مولکول پیش ساز نشاندار شده نیز در پلیمر زیستی گنجانده می شود. جای او را ثبت کنید
در قفس با استفاده از امولسیون عکاسی امکان پذیر است. اگر سلول های لایه یا برش با یک امولسیون عکاسی پوشانده شوند، پس از مدتی در نتیجه پوسیدگی ایزوتوپ، ذراتی که به طور تصادفی در جهات مختلف پرواز می کنند به منطقه لایه حساس نور می افتند و نقره را فعال می کنند. دانه های برمید موجود در آن هر چه زمان نوردهی طولانی تر باشد، یعنی تماس چنین سلول نشاندار شده با امولسیون عکاسی، دانه های AgBr بیشتری در معرض دید قرار می گیرند. پس از قرار گرفتن در معرض، لازم است آماده سازی توسعه یابد؛ در این مورد، نقره فقط در دانه های روشن کاهش می یابد؛ هنگامی که آماده سازی ثابت می شود، گرانول های AgBr در معرض قرار نگرفته حل می شوند. در نتیجه، از توده گرانول هایی که جسم را پوشانده اند، تنها آنهایی باقی می مانند که توسط تشعشعات؟ فعال شده اند. با نگاه کردن از طریق میکروسکوپ چنین آمادهسازیهایی که روی آن لایهای از امولسیون عکاسی اعمال میشود، محقق محل دانههای نقره را پیدا میکند که در مقابل مکانهایی که ماده برچسبدار در آن قرار دارد قرار دارند (شکل 9).
این روش دارای محدودیت هایی است: دقت آن بستگی دارد
بر روی اندازه دانه AgBr و انرژی ذرات. هرچه اندازه دانه بزرگتر باشد، مکان ایزوتوپ دقیق تر است. و هر چه انرژی ذره بیشتر باشد و مسیر آن طولانی تر باشد، فعال شدن دانه های AgBr از محل پوسیدگی دورتر خواهد بود. بنابراین، امولسیون های ویژه عکاسی ریزدانه (0.2-0.3 میکرومتر) و ایزوتوپ هایی با ذرات؟ کم انرژی، عمدتا ایزوتوپ هیدروژن، تریتیوم (3H) برای روش اتورادیوگرافی استفاده می شود. هر گونه پیش ساز ماکرومولکول های بیولوژیکی را می توان با تریتیوم برچسب گذاری کرد: نوکلئوتیدها، اسیدهای آمینه، قندها، اسیدهای چرب. هورمونهای نشاندار، آنتیبیوتیکها، مهارکنندهها و غیره نیز برای مطالعات رادیوآوتوگرافی استفاده میشوند.ترکیبات محلول در آب را نمیتوان با اتورادیوگرافی مطالعه کرد، زیرا ممکن است در طول درمان سلولها با محلولهای آبی (تثبیت، تظاهر و غیره) از بین بروند. یکی دیگر از محدودیت های روش، غلظت نسبتاً بالای این مواد است، زیرا در غلظت کم یک ماده رادیواکتیو، زمان قرار گرفتن در معرض افزایش می یابد، در حالی که
خطر ظهور پس زمینه گرانول های AgBr روشن به دلیل تابش کیهانی.
روش اتورادیوگرافی یکی از روش های اصلی است که به فرد امکان می دهد پویایی فرآیندهای مصنوعی را مطالعه کرده و شدت آنها را در سلول های مختلف در یک آماده سازی مقایسه کنیم. به عنوان مثال، با استفاده از این روش، با استفاده از پیش سازهای RNA نشاندار، نشان داده شد که تمام RNA تنها در هسته اینترفاز سنتز می شود و وجود RNA سیتوپلاسمی نتیجه مهاجرت مولکول های سنتز شده از هسته است.
روش اتورادیوگرافی نیز برای تعیین محل انواع خاصی از اسیدهای نوکلئیک یا توالی های نوکلئوتیدی منفرد در ترکیب هسته های سلولی یا کروموزوم ها - روش هیبریداسیون مولکولی - استفاده می شود. برای انجام این کار، محلولی با یک اسید نوکلئیک نشاندار شده (مثلاً با RNA ریبوزومی) یا با قطعه آن (مثلاً با DNA ماهواره ای) روی یک آماده سازی از قبل تیمار شده به منظور دناتوره کردن DNA (شکستن پیوندهای هیدروژنی در بومی) اعمال می شود. DNA) در ترکیب
کروموزوم ها یا هسته ها که با عملیات قلیایی یا دمایی نمونه حاصل می شود. در فرآیند بازسازی DNA، یک هیبرید مولکولی بین اسید نوکلئیک نشاندار شده از محلول و ناحیه DNA مکمل آن در آماده سازی تشکیل می شود. محل چنین هیبریداسیونی از طریق رادیوآتووگرافی تعیین می شود. این روش هیبریداسیون مولکولی اسیدهای نوکلئیک این امکان را فراهم می کند که مکان هایی با یک توالی نوکلئوتیدی معین در یک کروموزوم یا حتی مکان ژن های خاص را با دقت بسیار زیادی تعیین کنید.
روش هیبریداسیون مولکولی اسیدهای نوکلئیک نیز هنگام رنگ آمیزی آنها با فلوروکروم استفاده می شود. به عنوان مثال، اگر DNA هسته ای جدا شده که مسئول سنتز RNA ریبوزومی است، ابتدا به فلوئوروکروم متصل شده باشد، پس از بازسازی DNA در آماده سازی با این DNA ریبوزومی فلورسنت، می توان مشاهده کرد که فلورسانس فقط در هسته سلول های بین فازی مشاهده می شود. فقط در مناطق سازمان دهنده هسته کروموزوم های میتوزی. به این ترتیب
بومی سازی هر توالی DNA در سلول ها و حتی محل در هسته کروموزوم های منفرد امکان پذیر است. این تکنیک روش FISH (هیبریداسیون درجا فلورسنت) نامیده می شود.
میکروسکوپ الکترونی
با توجه به ویژگی های یک میکروسکوپ نوری، می توان متقاعد شد که تنها راه افزایش وضوح یک سیستم نوری، استفاده از منبع روشنایی است که امواجی با کوتاه ترین طول موج ساطع می کند. چنین منبعی می تواند یک رشته داغ باشد که در یک میدان الکتریکی جریانی از الکترون ها را خارج می کند، دومی می تواند با عبور از یک میدان مغناطیسی متمرکز شود. این به عنوان پایه ای برای ایجاد یک میکروسکوپ الکترونی عمل کرد که در آن وضوح 1 A (0.1 نانومتر) قبلاً به دست آمده است. طبق اصل طراحی، یک میکروسکوپ الکترونی بسیار شبیه به یک میکروسکوپ نوری است: دارای یک منبع روشنایی (کاتد تفنگ الکترونی)، یک سیستم کندانسور (عدسی مغناطیسی کندانسور)، یک شیئی (عدسی مغناطیسی عینی)، یک چشمی (مغناطیسی پروجکشن) لنزها)، اما به جای
در شبکیه چشم، الکترون ها روی یک صفحه درخشان یا روی یک صفحه عکاسی می افتند (شکل 7).
بخش اصلی چنین میکروسکوپی یک استوانه توخالی (ستون میکروسکوپ) است که از آن هوا به بیرون پمپ می شود تا برهمکنش الکترون ها با مولکول های گاز و اکسیداسیون رشته تنگستن در کاتد تفنگ الکترونی وجود نداشته باشد. یک ولتاژ بالا (از 50 تا 200-5000 کیلو ولت) بین کاتد و آند اعمال می شود که باعث شتاب گرفتن الکترون ها می شود. سوراخی در مرکز آند وجود دارد که از آن عبور می کند الکترون ها پرتویی را تشکیل می دهند که از ستون میکروسکوپ پایین می رود. عدسیهای میکروسکوپ الکترونی، آهنرباهای الکترونی هستند که میدان آنها میتواند مسیر الکترونها را تغییر دهد (همانطور که عدسیهای شیشهای مسیر فوتونها را تغییر میدهند). در یک عدسی کندانسور، یک پرتو الکترونی ثابت است و به جسمی برخورد میکند که الکترونها با آن برهمکنش میکنند، منحرف میشوند، پراکنده میشوند، جذب میشوند یا بدون تغییر از آن عبور میکنند. الکترون هایی که از جسم عبور می کنند توسط یک عدسی شیئی متمرکز می شوند که شکل می گیرد
تصویر اصلی بزرگ شده از شی درست مانند یک میکروسکوپ نوری، عدسی شیئی شاخص های اصلی آن را تعیین می کند. تصویر اولیه توسط یک عدسی برونتابی بزرگتر میشود و روی صفحهای که با لایهای درخشان پوشانده شده است، نمایش داده میشود که با برخورد الکترونها به آن میدرخشد. به جای یک صفحه نورانی، می توان تصویر را روی یک صفحه عکاسی قرار داد و یک عکس به دست آورد.
ولتاژ مورد استفاده برای شتاب دادن به الکترون ها در اکثر میکروسکوپ های الکترونی انتقالی (انتقالی) به 50-150 کیلو ولت می رسد. در ولتاژ 50 کیلو ولت، یک الکترون دارای طول موج 0.05 A است، و در این حالت، از نظر تئوری، وضوح 0.025 A (d ~ 0.5?) را می توان به دست آورد. با این حال، در طرحهای مدرن میکروسکوپهای الکترونی، به دلیل پایداری ناکافی ولتاژ، پایداری جریان عدسی، ناهمگنی فلز عدسیهای مغناطیسی و سایر عیوب دستگاه، وضوحی در حدود 1 A به دست میآید (از لحاظ نظری، امکان افزایش بیشتر وضوح یک میکروسکوپ الکترونی
100 بار). اما وضوح به دست آمده نیز بسیار زیاد است (به یاد داشته باشید که ارزش پیوند О-Н در یک مولکول آب 0.99 A است): در حال حاضر 106 برابر بیشتر از وضوح چشم است!
روی صفحه و صفحات عکاسی میکروسکوپ های الکترونی می توانید تا 50000 برابر بزرگنمایی دریافت کنید، سپس با چاپ عکس می توان بزرگنمایی 10 برابری دیگر به دست آورد، به طوری که بزرگنمایی نهایی، که در آن وضوح به حداکثر می رسد، می تواند به 106 برابر برسد. به عنوان مثال، اگر 1 میلی متر 106 برابر شود، طول آن به 1 کیلومتر می رسد).
در حال حاضر، یک تصویر میکروسکوپی الکترونی از یک صفحه فلورسنت مستقیماً با استفاده از یک دوربین تلویزیون دیجیتال به رایانه منتقل می شود، جایی که می توان آن را روی صفحه نمایشگر به روش های مختلف (تغییر بزرگنمایی، کنتراست تصویر، اعمال چگالی سنجی، صفحه و مورفومتری) پردازش کرد. از اجزای منفرد). با استفاده از چاپگر می توانید از تصاویر دریافتی پرینت بگیرید.
حداکثر وضوح یک میکروسکوپ الکترونی (EM) محقق می شود
اکنون فقط در مطالعه فلزات یا شبکه های کریستالی. تاکنون به دلیل کنتراست کم جسم، چنین تفکیک پذیری روی اجسام بیولوژیکی امکان پذیر نبوده است. اشیاء بیولوژیکی برای مطالعه در EM روی شبکههای مسی پوشیده شده با لایههای نازک قرار میگیرند - بسترهای (formvar، collodion، کربن)، که عمدتاً از کربن تشکیل شده است. اجسام بیولوژیکی نیز عمدتاً حاوی کربن هستند و بنابراین، چگالی کمی با پس زمینه دارند، کنتراست کمی خواهند داشت. نشان داده شده است که حداقل ضخامت یک جسم بیولوژیکی با چگالی حدود 1 گرم بر سانتی متر مکعب، که در ولتاژ شتاب دهنده در یک میکروسکوپ الکترونی 50 کیلو ولت شناسایی می شود، 50 A است. ویروس های واقع بر روی فیلم نگهدارنده در این مورد قابل مشاهده خواهند بود. به صورت لکه های بدون ساختار و مولکول های اسید نوکلئیک (ضخامت DNA 20 A است) به دلیل کنتراست کم اصلاً قابل مشاهده نیستند. کنتراست اجسام بیولوژیکی را می توان با استفاده از فلزات سنگین یا نمک آنها افزایش داد.
اجسام جسمی متضاد
اجسام جسمی را می توان ذرات ویروس ها، فاژها، اجزای سلولی جدا شده (ریبوزوم ها، غشاها، واکوئل ها و غیره)، ماکرومولکول ها نامید.
یکی از روشهای پرکاربرد برای تضاد اجسام بیولوژیکی، سایهزنی فلزی است. در این حالت تبخیر حرارتی فلز در تاسیسات خلاء ویژه انجام می شود. در این حالت، اتم های فلز از محل تبخیر در طول مسیرهای مستقیم پراکنده می شوند. هنگامی که آنها به یک جسم برخورد می کنند، به صورت یک لایه روی آن قرار می گیرند. ضخامت آن در نقاط عمود بر جهت پرواز ذرات فلز بیشتر خواهد بود. در مناطقی که جسم از پرتو ذرات محافظت می کند، "سایه ها" ظاهر می شوند. بنابراین، قسمت رسوبشده جسم دارای چگالی بالاتری نسبت به بستر رسوبشده (پسزمینه) است و بنابراین جسم قابل مشاهده خواهد بود. این روش نه تنها برای ویروس های متضاد، ریبوزوم ها، بلکه برای مولکول های نسبتاً نازک اسیدهای نوکلئیک نیز به طور گسترده استفاده می شود. عیب این روش این است که منجر به افزایش اندازه جسم در ضخامت می شود
لایه رسوبی که در بهترین حالت به 10-15 A می رسد. یکی دیگر از معایب آن این است که فقط اطلاعات ظاهری و حجم ذرات را ارائه می دهد. برای سایه زنی متضاد از پلاتین، پالادیوم، آلیاژهای آنها و اورانیوم استفاده می شود.
در صورت تضاد منفی اجسام با محلول های نمک فلزات سنگین، از مولیبدات آمونیوم، استات اورانیل، اسید فسفوتنگستیک (PTA) استفاده می شود (شکل 10). اگر محلولهای آبی چنین موادی با اجسام بیولوژیکی مخلوط شده و سپس روی لایههای زیرلایه اعمال شده و خشک شوند، به نظر میرسد که اجسام (مثلاً ویروسها یا کمپلکسهای پروتئینی) در لایه نازکی از یک ماده آمورف با چگالی بالا غوطهور شوند. در یک میکروسکوپ الکترونی، آنها مانند اجسام روشن در یک پس زمینه تاریک (مانند نگاتیو عکس) به نظر می رسند. مزیت این روش این است که نمک های محلول می توانند به عمق جسم نفوذ کنند و جزئیات اضافی آن را آشکار کنند. کنتراست منفی به طور گسترده ای در مطالعه ویروس ها و کمپلکس های آنزیمی غشایی استفاده می شود. مولکول های اسید نوکلئیک رشته ای با این روش
بدلیل ضخامت کوچکشان ضعیف شناسایی می شوند.
نمک های فلزات سنگین را می توان در رنگ آمیزی به اصطلاح مثبت استفاده کرد. در این حالت ماده کنتراست به ساختار متصل شده و چگالی الکترونی آن را افزایش می دهد. اغلب از محلول های اورانیل استات در الکل یا استون برای رنگ آمیزی مثبت اسیدهای نوکلئیک استفاده می شود. اورانیل استات، اسیدهای نوکلئیک متضاد، به خوبی حفره های مرکزی ویروس های کروی را رنگ می کند، کنتراست ریبوزوم ها را به میزان قابل توجهی افزایش می دهد و به شما امکان می دهد رشته های نازکی از اسیدهای نوکلئیک جدا شده را ببینید.
اولترامیکروتومی
هنگام مطالعه اشیاء در میکروسکوپ الکترونی، عارضه دیگری ایجاد می شود - این ضخامت آنها است. واقعیت این است که وقتی یک پرتو الکترونی از یک جسم عبور می کند، مقداری از الکترون ها جذب می شوند که منجر به گرم شدن جسم و تغییر شکل آن می شود. بنابراین، داشتن اجسام نازک (نه بیشتر از 0.1 میکرون) ضروری است. محدودیت دیگر این است که حتی اگر اجسام تغییرناپذیر با ضخامت زیاد (حدود
0.5-1 میکرومتر)، که در اصل امکان پذیر است (به عنوان مثال، در یک میکروسکوپ الکترونی مگا ولت، به زیر مراجعه کنید)، سپس برآمدگی ساختارهایی که در سطوح مختلف در امتداد ضخامت جسم قرار دارند، بر روی تصویر نهایی قرار می گیرند. بنابراین، مطالعه ساختار داخلی سلول های کامل در میکروسکوپ های انتقال بد و ناخوشایند است. راه خروج از این وضعیت مشابه چیزی است که برای میکروسکوپ نوری یافت شد - برای ایجاد مقاطع با ضخامت بسیار کوچک، مقاطع بسیار نازک (0.05-0.10 میکرون).
روش ساخت آنها در اصل مشابه روشی است که در میکروسکوپ نوری استفاده می شود. سلول ها و بافت ها برای این ابتدا ثابت می شوند. محلول های بافر گلوتارآلدئید یا تتروکسید اسمیم به عنوان تثبیت کننده استفاده می شود. متداول ترین تثبیت مضاعف: ابتدا گلوتارآلدئید و سپس اسمیم که مانند یک فلز سنگین ساختارهای سلولی را متضاد می کند. سپس، پس از کم آبی، پارچه ها با رزین های اپوکسی یا سایر پلاستیک ها در یک مایع مونومر آغشته می شوند.
فرم. در طی پلیمریزاسیون چنین پلاستیکهایی، جسم آغشته به آنها در بلوکهای جامد محصور میشود که میتوان آنها را از قبل به بخشهای نازک برش داد. در اینجا دو مشکل پیش میآید: از کجا میتوان چاقوهای ایدهآل را تهیه کرد، نقصهایی که بر مطالعه سلولها در سطوح تقریباً مولکولی تأثیر نمیگذارد، و نحوه ساختن بخشهایی به نازکی صدم میکرون. اولین مشکل به این ترتیب حل شد: معلوم شد که تراشه های شیشه ای سطح برشی کاملاً تیز و بدون بریدگی دارند (شکل 11). اما چاقوهای شیشه ای بسیار کوتاه مدت هستند، آنها فقط یک بار استفاده می شوند. از چاقوهای الماسی استفاده می شود: اینها الماس های کوچکی هستند که به روش خاصی تیز شده اند، آنها چندین سال خدمت می کنند.
مشکل ساخت یک بخش فوق العاده نازک نیز حل شد، به نظر می رسد به سادگی - این منبع حرارتی جسم است. یک بلوک با یک جسم محصور شده در پلاستیک روی یک میله فلزی نصب شده است که گرم می شود و در نتیجه جسم را به میزان مشخصی در زمان مشخصی به جلو حرکت می دهد. و اگر این منبع حرارتی با چرخه های ریتمیک هماهنگ شود
با برش، می توان یک سری برش با ضخامت معین به دست آورد. این با استفاده از دستگاه های ویژه - اولترامیکروتوم ها به دست می آید. طرح هایی از اولترامیکروتوم ها وجود دارد که جسم به صورت مکانیکی تغذیه می شود.
مساحت بخش های فوق نازک حاصل معمولاً بسیار کوچک است (1-0.1 میلی متر مربع)، بنابراین تمام عملیات در طول اولترامیکروتومی تحت کنترل میکروسکوپی است. بخش های نصب شده روی شبکه ها با یک بستر باید علاوه بر این متضاد - با کمک نمک های فلزات سنگین "لکه دار شوند". در این مورد از نمک های سرب و اورانیوم نیز استفاده می شود که با اتصال به ساختارهای درون سلولی روی برش، تضاد مثبت آنها را ایجاد می کند.
تکنیک ساخت مقاطع فوق نازک فرصت های عظیمی را برای کاربرد میکروسکوپ الکترونی به معنای واقعی کلمه در تمام زمینه های زیست شناسی و پزشکی باز کرده است.
این روش امکان استفاده از تکنیک های سیتوشیمیایی را در سطح میکروسکوپ الکترونی فراهم می کند: در این مورد، لازم است که محصولات واکنش الکترونی متراکم باشند، رد شوند.
الکترون خواهد بود علاوه بر این، واکنش ها نباید منجر به ظهور الگوهای مصنوع در سطح فراساختاری شوند. تعداد روش های سیتوشیمیایی در میکروسکوپ الکترونی هنوز زیاد نیست، اما این جهت به شدت در حال توسعه است.
در مطالعات میکروسکوپی الکترونی، امکان استفاده از روش های اتورادیوگرافی وجود داشت. در این مورد، از امولسیون های بسیار ریز دانه استفاده می شود (اندازه گرانول ها حدود 0.02-0.06 میکرومتر است). عیب این روش زمان نوردهی بسیار طولانی است که در برخی موارد به چند ماه می رسد.
استفاده روزافزون از روش هایی برای تهیه مقاطع فوق نازک بدون تثبیت و برای جاسازی سلول ها در پلاستیک جامد در حال انجام است. اینها روشهای کرایولترامیکروتومی هستند، یعنی. به دست آوردن مقاطع از بافت های یخ زده، بلافاصله تا دمای نیتروژن مایع (196- درجه سانتیگراد) خنک می شود. در این حالت، مهار تقریباً آنی کلیه فرآیندهای متابولیک رخ می دهد و آب از فاز مایع به یک جامد، اما نه کریستالی تبدیل می شود.
ساختار مولکولی آن بی نظم است (حالت شیشه ای). چنین بلوک های جامد در دمای نیتروژن مایع را می توان به بخش های بسیار نازک برش داد (چاقو نیز خنک می شود). بخش های به دست آمده برای تشخیص فعالیت آنزیم ها در آنها، انجام واکنش های ایمونوشیمیایی روی آنها، هضم آنزیمی و غیره استفاده می شود.
برای مطالعات ایمونوشیمیایی، از آنتی بادی هایی استفاده می شود که با ذرات طلای کلوئیدی مرتبط هستند، که محلی سازی آن روی آماده سازی نشان دهنده محل آنتی ژن مورد نظر است.
مطالعه مقاطع بهدستآمده بر روی کرایولتراتومها نشان داد که ساختار و ترکیب کلی اجزای سلولی در این مورد با آنچه که هنگام استفاده از تثبیت شیمیایی و روشهای مرسوم برای به دست آوردن مقاطع بسیار نازک مشاهده میشود، تفاوت کمی دارد. در نتیجه، آن دسته از سازههایی که ترکیبات یکسانی با روشهای مختلف پردازش مواد دارند، ظاهراً نزدیک به ساختار طول عمرشان، مصنوع نیستند.
این توسط داده های مربوط به مطالعه سلول ها با استفاده از روش های دیگر میکروسکوپ الکترونی پشتیبانی می شود.
روش انجماد-شکاف برای مطالعه ساختار اجزای مختلف غشای یک سلول استفاده می شود. این شامل این واقعیت است که جسم ابتدا به سرعت با نیتروژن مایع منجمد می شود و سپس در همان دما به یک واحد خلاء ویژه منتقل می شود. در آنجا، جسم یخ زده به طور مکانیکی با یک چاقوی سرد جدا می شود. در این حالت، نواحی داخلی سلول های یخ زده در معرض دید قرار می گیرند.در خلاء، بخشی از آبی که به شکل زجاجیه تبدیل شده است تصعید می شود ("اچ") و سطح شکاف به طور متوالی با یک لایه نازک از کربن تبخیر شده پوشانده می شود. ، و سپس فلز. بنابراین، یک کپی از برش آن از یک ماده منجمد شده و ساختار درون حیاتی آن حفظ می شود (شکل 12). سپس، در دمای اتاق، بافت یا سلولها در اسیدها حل میشوند، اما فیلم ماکت دست نخورده باقی میماند، زیر میکروسکوپ الکترونی مطالعه میشود. این روش دو مزیت دارد: آنها کپی ها را از تراشه ها مطالعه می کنند
نمونه های بومی؛ بررسی برجستگی سطح غشای سلولی که با روش های دیگر دست نیافتنی است. مشخص شد که در این مورد نیز سازماندهی کلی سلول و اجزای آن شبیه به آنچه در حین تثبیت شیمیایی یا کرایوتومی می بینیم است. این روش این امکان را فراهم می کند که ببینیم گلبول های پروتئین های انتگرال هم روی سطح و هم در ضخامت غشای سلولی قرار دارند و غشاها در ساختار خود یکنواخت نیستند.
روش به دست آوردن ماکت از ریزنقشه یک نمونه به طور گسترده ای در مطالعه اجزای فیبریلار یک سلول استفاده می شود. بنابراین، هنگام مطالعه اسکلت سلولی سلول های کشت بافت یا سلول های خونی، سلول ها با مواد شوینده درمان می شوند تا تمام غشاها حل شوند. این منجر به این واقعیت می شود که تمام اجزاء از سلول شسته می شوند، به جز اجزای پروتئین فیبریلار اسکلت سلولی و مواد هسته ای. سپس چنین آماده سازی ها به روش خاصی ثابت، آبگیری و خشک می شوند. پس از آن، فرآورده های خشک با کربن پاشیده شده و با اسپری ضد رنگ می شوند.
فلزات سنگین، پس از آن، چنین ماکتی از شیشه ای که سلول ها روی آن رشد کرده اند، برداشته می شود و در یک میکروسکوپ الکترونی عبوری مشاهده می شود.
سایر روشهای ویژه میکروسکوپ الکترونی اجسام بیولوژیکی
اخیراً روش های میکروسکوپ ولتاژ بالا (یا بهتر است بگوییم فوق ولتاژ بالا) شروع به استفاده از آنها شده است. دستگاه هایی با ولتاژ شتاب دهنده 1-3 میلیون ولت طراحی شده است. اینها وسایل بسیار گران قیمتی هستند که مانع استفاده گسترده از آنها می شود. مزیت این دسته از میکروسکوپهای الکترونی این نیست که میتوانند وضوح بالاتری (در طول موج الکترونی کوتاهتر) به دست آورند، بلکه در انرژیهای الکترونی بالا که کمتر توسط جسم جذب میشوند، میتوان نمونههایی با ضخامت زیاد را مشاهده کرد. 1-10 میکرومتر). استفاده اضافی از تصویربرداری استریوسکوپی امکان به دست آوردن اطلاعات در مورد سازماندهی سه بعدی ساختارهای درون سلولی با وضوح بالای آنها (حدود 0.5 نانومتر) را فراهم می کند.
روش اسکن (رستر) میکروسکوپ الکترونی اجازه می دهد
تصویر سه بعدی سطح سلول را مطالعه کنید. در میکروسکوپ الکترونی روبشی، یک پرتو نازک از الکترون ها (کاوشگر) روی سطح یک جسم می گذرد و اطلاعات به دست آمده به یک لوله پرتو کاتدی منتقل می شود. تصویر را می توان در الکترون های منعکس شده یا ثانویه به دست آورد. با این روش، یک جسم ثابت و مخصوص خشک شده با یک لایه نازک از فلز تبخیر شده (اغلب طلا) پوشیده می شود که از آن الکترون ها وارد دستگاه گیرنده می شوند که سیگنالی را به یک لوله پرتو کاتدی منتقل می کند. با توجه به عمق بسیار زیاد تمرکز میکروسکوپ روبشی که بسیار بیشتر از میکروسکوپ انتقال است، تصویر تقریباً سه بعدی از سطح مورد مطالعه به دست می آید. وضوح این نوع ابزار تا حدودی کمتر از میکروسکوپ های الکترونی عبوری است، اما ابزارهایی با وضوح 3-5 نانومتر در حال حاضر تولید می شوند (شکل 13).
با استفاده از میکروسکوپ الکترونی روبشی، می توان اطلاعاتی در مورد ترکیب شیمیایی در مناطق خاص به دست آورد.
سلول ها. بنابراین، روش میکروآنالیز طیفی پرتو ایکس مبتنی بر شناسایی و ارزیابی کمی محتوای عناصر شیمیایی با توجه به طیفهای تابش پرتو ایکس مشخصه ناشی از تعامل الکترونهای اولیه با اتمهای یک جسم است. برای به دست آوردن چنین اطلاعاتی، البته مانند روش معمول میکروسکوپ الکترونی روبشی، اجسام نباید با یک لایه فلز پوشانده شوند. علاوه بر این، شی باید به گونه ای آماده شود که از بین رفتن یا ورود اضافی عناصر وجود نداشته باشد. برای این کار از اشیاء سریع منجمد و خشک شده با خلاء استفاده می شود.
تقسیم سلولی
در سیتولوژی، روش های مختلف بیوشیمی، اعم از تحلیلی و آماده سازی، به طور گسترده استفاده می شود. در مورد اخیر، اجزای مختلفی را می توان به صورت فراکسیون های جداگانه به دست آورد و ترکیب شیمیایی، فراساختار و خواص آنها را بررسی کرد. بنابراین، در حال حاضر، تقریباً هر اندامک و ساختار سلولی به شکل بخش های خالص به دست می آید: هسته، هسته، کروماتین،
غشاهای هسته ای، غشای پلاسمایی، واکوئل های شبکه آندوپلاسمی، ریبوزوم های آن، ریبوزوم های هیالوپلاسمی، دستگاه گلژی، میتوکندری ها، غشاهای آنها، پلاستیدها، پراکسی زوم ها، میکروتوبول ها و غیره. اخیراً بخش های خالص سانتریول ها و منافذ هسته ای به دست آمده است.
به دست آوردن بخش های سلولی با تخریب کلی سلول، با همگن شدن آن آغاز می شود. سپس فراکسیون ها را می توان از هموژن ها جدا کرد. یکی از راه های اصلی جداسازی ساختارهای سلولی سانتریفیوژ تفاضلی (جداسازی) است. اصل کاربرد آن این است که زمان ته نشین شدن ذرات در همگن به اندازه و چگالی آنها بستگی دارد: هر چه ذره بزرگتر یا سنگین تر باشد، سریعتر در ته لوله آزمایش ته نشین می شود. برای تسریع این فرآیند ته نشینی، از شتاب های ایجاد شده توسط سانتریفیوژ استفاده می شود. در طول سانتریفیوژ، هسته ها و سلول های تخریب نشده ابتدا و با شتاب های کوچک (1-3 هزار گرم)، در 15-30 هزار گرم ذرات بزرگ، ماکروزوم های متشکل از میتوکندری، پلاستیدهای کوچک، ته نشین می شوند.
پراکسی زوم ها، لیزوزوم ها و غیره، در 50 هزار گرم، میکروزوم ها، قطعات سیستم واکوئولی سلول، ته نشین می شوند. با سانتریفیوژ کسری مکرر این زیر فراکسیون های مخلوط می توان فراکسیون های خالص را به دست آورد. بنابراین، هنگام جداسازی زیربخش ماکروزومی، میتوکندری ها، لیزوزوم ها و پراکسی زوم ها به طور جداگانه به دست می آیند. هنگام جداسازی میکروزوم ها، می توان کسری از غشای دستگاه گلژی، قطعات غشای پلاسمایی، واکوئل ها و شبکه دانه ای را به دست آورد. در موارد جداسازی ریزتر فراکسیون ها، از سانتریفیوژ گرادیان چگالی ساکارز استفاده می شود که این امکان را فراهم می کند تا اجزاء را به خوبی از هم جدا کنند، حتی کمی با یکدیگر در وزن مخصوص متفاوت باشند.
فراکسیون های به دست آمده، قبل از اینکه با روش های بیوشیمیایی تجزیه و تحلیل شوند، باید با استفاده از میکروسکوپ الکترونی از نظر خلوص بررسی شوند.
به دست آوردن اجزای سلولی منفرد، مطالعه بیوشیمی و ویژگی های عملکردی آنها را ممکن می سازد. بنابراین می توانید یک سیستم بدون سلول برای ریبوزوم ها ایجاد کنید که این کار را انجام می دهد
سنتز پروتئین با توجه به RNA پیام رسان مشخص شده توسط آزمایشگر، میتوکندری های جدا شده در شرایط انتخابی می توانند سنتز ATP را انجام دهند، سنتز RNA می تواند بر روی کروماتین جدا شده با مشارکت آنزیم های مناسب رخ دهد و غیره.
اخیراً از سیستم های بدون سلول برای بازسازی ساختارهای فوق مولکولی سلولی استفاده شده است. بنابراین، با استفاده از زرده های خالص شده از گرانول ها، عصاره های سیتوپلاسم تخم دوزیستان یا تخم خارپشت دریایی، می توان هسته هایی با پوشش هسته ای از DNA خارجی وارد شده به این سیستم عاری از سلول (به عنوان مثال، DNA باکتریوفاژ) به دست آورد. چنین DNA به پروتئین های هیستونی متصل می شود، که در چنین عصاره ای بیش از حد وجود دارد، کروماتین (دئوکسی ریبونوکلئوپروتئین) تشکیل می شود که با یک غشای دوگانه پوشیده شده است که حتی منافذ هسته ای را حمل می کند. چنین سیستم های مدلی به مطالعه فرآیندهای ظریف و صمیمی، مانند انتقال ماکرومولکول ها از سیتوپلاسم به هسته و بالعکس کمک می کنند. در عصاره سیتوپلاسمی تخم دوزیستان و خارپوستان
چنین هسته هایی می توانند به طور دوره ای با میتوز تقسیم شوند. این مدل ها کمک زیادی به رمزگشایی از ماهیت تنظیم چرخه سلولی کرده اند.
کمک بزرگی به زیست شناسی سلول توسط روش های مهندسی سلولی انجام می شود. مشخص شد که سلول های زنده مختلف می توانند با یکدیگر ادغام شوند اگر غشای پلاسمایی آنها به روش های خاصی درمان شود. بنابراین می توانید یک گلبول قرمز مرغ و یک لنفوسیت انسانی را ادغام کنید. در این مورد، یک سلول دو هسته ای به دست می آید، یک هتروکاریون، که در آن هسته یک گلبول قرمز مرغ فعال می شود (شکل 14). اگر هتروکاریون از سلولهای نزدیک به هم (مثلاً موش و همستر) تشکیل شود، وقتی وارد میتوز میشوند، کروموزومها میتوانند در یک صفحه متافاز متحد شوند. پس از جداسازی چنین سلولی، یک سلول هیبرید واقعی به دست می آید. تکنیکهای دیگر ساخت سلولها از هستهها و سیتوپلاسمهایی با منشأ متفاوت را ممکن میسازد (شکل 15). بنابراین، با از بین بردن جزء اکتین اسکلت سلولی و قرار دادن سلول ها در معرض سانتریفیوژ، سلول را می توان به دو بخش تقسیم کرد: هسته.
با لبه باریک سیتوپلاسم - کاریوپلاسم و روی بقیه سیتوپلاسم - سیتوپلاست. سپس با استفاده از کاریوپلاست ها و سیتوپلاست های مختلف می توانید ترکیبات مختلفی از سلول های بازسازی شده ایجاد کنید.
روش های مهندسی سلول نه تنها در زیست شناسی تجربی، بلکه برای اهداف بیوتکنولوژیکی نیز به طور گسترده مورد استفاده قرار می گیرند. به عنوان مثال، در تولید آنتی بادی های مونوکلونال، هیبریدهای سلولی بین لنفوسیت های حیوانات ایمن شده و سلول های میلوما که به سرعت تکثیر می شوند، استفاده می شود. دیکاریون های اولیه به دست آمده سلول های هیبریدی واقعی را تشکیل می دهند که به دلیل ژنوم سلول های تومور میلوم به شدت تکثیر می شوند و در همان زمان مقدار زیادی آنتی بادی را به دلیل کار ژنوم لنفوسیت های ایمن شده آزاد می کنند. این تکنیک به شما امکان می دهد تعداد زیادی سلول هیبریدوما را بدست آورید که مقادیر زیادی آنتی بادی لازم را تولید می کنند.
لازم نیست تمام روش ها و تکنیک های مورد استفاده در سیتولوژی برای مطالعه ساختار، شیمی و
عملکرد سلول ها یا اجزای آنها این بررسی مختصر برای نشان دادن غنای زرادخانه روش ها در سیتولوژی کافی است که امکان تجزیه و تحلیل دقیق را از شکل، ظاهر کلی و اندازه سلول گرفته تا ترکیب مولکولی بخش های جداگانه آن فراهم می کند.
سخنرانی 13. میکروسکوپی به عنوان روشی برای مطالعه سلول ها و بافت ها.
1. میکروسکوپ نوری.
2. میکروسکوپ الکترونی.
سیتولوژی مدرن دارای روش های تحقیقاتی متعدد و متنوعی است که بدون آنها جمع آوری و بهبود دانش در مورد ساختار و عملکرد سلول ها غیرممکن است. در این فصل تنها با اصلی ترین و مهم ترین روش های تحقیق آشنا می شویم.
میکروسکوپ نوری مدرن یک ابزار بسیار عالی است که هنوز هم در مطالعه سلولها و اندامکهای آنها از اهمیت بالایی برخوردار است. با کمک میکروسکوپ نوری افزایش 2000-2500 برابری حاصل می شود. بزرگنمایی یک میکروسکوپ به وضوح آن بستگی دارد، یعنی کوچکترین فاصله بین دو نقطه که به طور جداگانه قابل مشاهده هستند.
هرچه ذره ای که از طریق میکروسکوپ دیده می شود کوچکتر باشد، قدرت تفکیک آن بیشتر است. دومی به نوبه خود توسط دیافراگم لنز (دیافراگم باز شدن موثر سیستم نوری است که با اندازه لنزها یا روزنه ها تعیین می شود) و طول موج نور تعیین می شود.
تعیین وضوح میکروسکوپ با فرمول انجام می شود: a = 0.6، که در آن a حداقل فاصله بین دو نقطه است. - طول موج نور؛ n ضریب شکست محیطی است که بین آماده سازی و عدسی شیئی اول یعنی جلویی قرار دارد. a زاویه بین محور نوری عدسی و شدیدترین پرتویی است که وارد عدسی می شود یا زاویه پراش پرتوها.
مقدار نشان داده شده در مخرج کسر (n sin a) برای هر عدسی ثابت است و دیافراگم عددی آن نامیده می شود. دیافراگم عددی و همچنین بزرگنمایی روی بشکه لنز حک شده است. رابطه بین دیافراگم عددی و حداقل فاصله تفکیک پذیری به شرح زیر است: هرچه دیافراگم عددی بزرگتر باشد، این فاصله کوچکتر است، یعنی وضوح میکروسکوپ بالاتر است.
افزایش وضوح میکروسکوپ، که برای مطالعه جزئیات ساختار سلول کاملاً ضروری است، از دو طریق به دست می آید:
1) افزایش دیافراگم عددی هدف؛
2) کاهش طول موج نوری که دارو را روشن می کند.
اهداف غوطه وری برای افزایش دیافراگم عددی استفاده می شود. موارد زیر به عنوان مایع استفاده می شوند: آب (n = 1.33)، گلیسیرین (n = 1.45)، روغن سرو (/1 = 1.51) در مقایسه با n هوا برابر با 1.
از آنجایی که ضریب شکست مایعات غوطه ور بزرگتر از 1 است، دیافراگم عددی شیء افزایش می یابد و پرتوها می توانند به آن وارد شوند و زاویه بزرگ تری با محور نوری شیء ایجاد می کنند تا زمانی که هوا بین عدسی جلویی شی و شیء وجود دارد. آماده سازی.
راه دوم برای افزایش وضوح میکروسکوپ استفاده از پرتوهای فرابنفش است که طول موج آن کمتر از طول موج پرتوهای نور مرئی است.
با این حال، وضوح یک میکروسکوپ را فقط می توان تا حد معینی افزایش داد که توسط طول موج نور محدود می شود. کوچکترین ذرات که به وضوح در یک میکروسکوپ نوری مدرن قابل مشاهده هستند باید مقداری بیشتر از "/z طول موج نور داشته باشند. به این معنی که هنگام استفاده از قسمت مرئی نور روز با طول موج 0.004 تا 0.0007 میلی متر، ذرات حداقل حداقل 0 0002-0.0003 میلی متر بنابراین، با کمک میکروسکوپ های مدرن می توان آن دسته از جزئیات ساختار سلول را در نظر گرفت که دارای ارزش حداقل 0.2-0.3 میکرون هستند.
در حال حاضر مدل های مختلفی از میکروسکوپ های نوری ساخته شده اند. آنها امکان مطالعه چند وجهی ساختارهای سلولی و عملکرد آنها را فراهم می کنند.
میکروسکوپ بیولوژیکی میکروسکوپ بیولوژیکی (MBI-1، MBI-2، MBI-3، MBR، و غیره) برای مطالعه آماده سازی های روشن شده توسط نور عبوری طراحی شده است. این نوع میکروسکوپ است که بیشترین کاربرد را برای مطالعه ساختار سلول ها و سایر اشیاء دارد.
با این حال، با کمک یک میکروسکوپ بیولوژیکی، می توان به طور دقیق آماده سازی سلولی عمدتا ثابت و رنگ آمیزی شده را مطالعه کرد. بیشتر سلولهای زنده و رنگآمیزی در نور عبوری بیرنگ و شفاف هستند (نور را جذب نمیکنند)، و نمیتوان آنها را با جزئیات دید.
میکروسکوپ کنتراست فاز. تصویر کنتراست آماده سازی سلول های زنده، تقریباً نامرئی هنگام مشاهده در میکروسکوپ بیولوژیکی، یک دستگاه کنتراست فاز را ارائه می دهد).
روش کنتراست فاز مبتنی بر این واقعیت است که بخش های جداگانه یک آماده سازی شفاف از نظر ضریب شکست با محیط متفاوت است. بنابراین، نوری که از آنها می گذرد با سرعت های مختلفی منتشر می شود، یعنی تغییر فاز را تجربه می کند که با تغییر در روشنایی بیان می شود. تغییرات فاز امواج نور به ارتعاشات نور با دامنه های مختلف تبدیل می شود و تصویر کنتراست نمونه با چشم درک می شود که در آن توزیع روشنایی با توزیع فرصت های گسترده در مطالعه سلول های زنده، اندامک ها و اجزای آنها مطابقت دارد. در حالت دست نخورده این شرایط نقش مهمی ایفا می کند، زیرا تثبیت و رنگ آمیزی سلول ها، به عنوان یک قاعده، به ساختارهای سلولی آسیب می رساند.
دستگاه کنتراست فاز برای میکروسکوپ بیولوژیکی شامل مجموعه ای از اهداف فاز است که در حضور یک صفحه فاز حلقوی، یک کندانسور با مجموعه ای از دیافراگم های حلقوی، و یک میکروسکوپ کمکی که تصویر را بزرگ می کند با موارد معمول متفاوت است. دیافراگم حلقوی و صفحه فاز زمانی که با هم ترکیب می شوند.
میکروسکوپ تداخلی روش کنتراست تداخلی به روش میکروسکوپ کنتراست فاز نزدیک است و امکان به دست آوردن تصاویر کنتراست از سلول های زنده شفاف بدون رنگ و همچنین محاسبه وزن خشک سلول ها را فراهم می کند. یک میکروسکوپ تداخل ویژه ای که برای این اهداف استفاده می شود به گونه ای طراحی شده است که پرتوی از پرتوهای نور موازی که از یک منبع نور می آید به دو شاخه موازی - بالا و پایین تقسیم می شود.
شاخه پایینی از مرحله آماده سازی عبور می کند و فاز نوسان نور آن تغییر می کند، در حالی که موج بالایی بدون تغییر باقی می ماند. برای دارو، یعنی. در منشورهای هدف، هر دو شاخه دوباره به هم متصل شده و با یکدیگر تداخل دارند. در اثر تداخل، بخش هایی از فرآورده با ضخامت های مختلف یا ضریب شکست نابرابر به رنگ های مختلف رنگ آمیزی شده و متضاد و به وضوح قابل مشاهده می شود.
میکروسکوپ فلورسانس. مانند روش کنتراست فاز، میکروسکوپ فلورسنت (یا لومینسنت) امکان مطالعه یک سلول زنده را فراهم می کند. فلورسانس درخشندگی یک جسم است که توسط انرژی نور جذب شده توسط آن برانگیخته می شود. فلورسانس می تواند توسط اشعه ماوراء بنفش و همچنین پرتوهای آبی و بنفش برانگیخته شود.
تعدادی از ساختارها و مواد موجود در سلول ها فلورسانس خاص خود را دارند (یا اولیه). به عنوان مثال، رنگدانه سبز کلروفیل، که در کلروپلاست سلول های گیاهی یافت می شود، دارای فلورسانس قرمز روشن است. ویتامینهای A و B، برخی رنگدانههای سلولهای باکتریایی، درخشش بسیار روشنی به آن میدهند. این امکان شناسایی گونه های باکتریایی را فراهم می کند.
با این حال، بیشتر مواد موجود در سلول ها فلورسانس خاص خود را ندارند. چنین موادی شروع به درخشش میکنند و رنگهای متنوعی را نشان میدهند، فقط پس از درمان اولیه با رنگهای درخشان (فلورسانس ثانویه). این رنگها فلوروکروم نامیده می شوند.آنها شامل فلورسین، آکریدین نارنجی، بربرین سولفات، فلوکسین و غیره هستند.فلوروکروم ها معمولاً در غلظت های بسیار کم (مثلاً 1:10000، 1:100000) استفاده می شوند و به سلول زنده آسیب نمی رسانند. بسیاری از فلوئوروکروم ها به طور انتخابی ساختارها و مواد سلولی را در یک نور خاص رنگ می کنند. بنابراین، تحت شرایط خاص، آکریدین نارنجی، اسید دئوکسی ریبونوکلئیک (DNA) را سبز رنگ و اسید ریبونوکلئیک (RNA) نارنجی را رنگ می کند. بنابراین، فلورسانس ثانویه با پرتقال آکریدین در حال حاضر یکی از روش های مهم برای مطالعه محل یابی اسیدهای نوکلئیک در سلول های موجودات مختلف است.
علاوه بر این، استفاده از فلوئوروکروم ها به دست آوردن آماده سازی های کنتراست که برای مشاهده راحت هستند را ممکن می کند، که بر روی آن می توان ساختارهای مورد نظر را پیدا کرد، سلول های باکتری را تشخیص داد و آنها را شمارش کرد. روش میکروسکوپ فلورسانس نیز امکان بررسی تغییرات سلول ها و ساختارهای درون سلولی فردی را در حالت های عملکردی مختلف فراهم می کند و تشخیص سلول های زنده و مرده را ممکن می سازد.
هنگامی که از پرتوهای آبی و بنفش نور به عنوان منبع فلورسانس استفاده می شود، تجهیزات شامل یک میکروسکوپ بیولوژیکی معمولی، یک لامپ ولتاژ پایین (برای میکروسکوپ) و یک فیلتر نور آبی است که پرتوهای تحریک کننده فلورسانس را عبور می دهد و یک زرد. فیلتر نوری که اشعه های آبی بیش از حد را حذف می کند. استفاده از پرتوهای فرابنفش به عنوان منبع فلورسانس نیازمند یک میکروسکوپ فلورسنت خاص با اپتیک کوارتز است که پرتوهای فرابنفش را منتقل می کند.
میکروسکوپ پلاریزه. روش میکروسکوپ پلاریزه بر اساس توانایی اجزای مختلف سلول ها و بافت ها در شکست نور پلاریزه است. برخی از ساختارهای سلولی، به عنوان مثال، الیاف دوکی، میوفیبریل ها، مژک های اپیتلیوم مژک دار و غیره، با جهت گیری خاصی از مولکول ها مشخص می شوند و دارای خاصیت انکسار مضاعف هستند. اینها به اصطلاح ساختارهای ناهمسانگرد هستند.
ساختارهای ناهمسانگرد با استفاده از میکروسکوپ پلاریزه بررسی می شوند. تفاوت آن با یک میکروسکوپ بیولوژیکی معمولی در این است که یک پلاریزه در جلوی کندانسور قرار میگیرد و یک جبرانکننده و یک آنالایزر در پشت آمادهسازی و هدف قرار میگیرند که امکان مطالعه دقیق دوشکستگی در جسم مورد بررسی را فراهم میکند. در عین حال، معمولاً ساختارهای روشن یا رنگی در سلول ها مشاهده می شود که ظاهر آنها به موقعیت دارو نسبت به صفحه قطبش و به بزرگی شکست دوگانه بستگی دارد.
یک میکروسکوپ پلاریزه تعیین جهت ذرات در سلول ها و سایر ساختارها، مشاهده واضح ساختارهای دارای انکسار دوگانه و با پردازش مناسب آماده سازی، امکان مشاهداتی در مورد سازماندهی مولکولی یک یا آن قسمت از سلول را فراهم می کند. .
میکروسکوپ میدان تاریک مطالعه آماده سازی در یک میدان تاریک با استفاده از یک کندانسور ویژه انجام می شود. کندانسور میدان تاریک با کندانسور میدان روشن معمولی از این جهت متفاوت است که فقط پرتوهای لبه بسیار مورب منبع نور را منتقل می کند. از آنجایی که پرتوهای لبه به شدت کج هستند، وارد شیء نمی شوند و میدان دید میکروسکوپ تاریک است و جسمی که با نور منتشر روشن می شود، روشن به نظر می رسد.
آماده سازی سلولی معمولاً حاوی ساختارهایی با چگالی نوری متفاوت است. در یک پس زمینه تاریک عمومی، این ساختارها به دلیل درخشندگی متفاوتشان به وضوح قابل مشاهده هستند و به دلیل پراکندگی پرتوهای نوری که بر روی آنها می افتند (اثر تیندال) می درخشند.
انواع سلول های زنده را می توان در یک میدان تاریک مشاهده کرد.
میکروسکوپ فرابنفش. اشعه ماوراء بنفش (UV) توسط چشم انسان درک نمی شود، به همین دلیل است که مطالعه مستقیم سلول ها و ساختار آنها در آنها غیرممکن است. به منظور مطالعه آماده سازی سلولی در اشعه UV، E.M. برومبرگ (1939) میکروسکوپ فرابنفش اصلی MUF-1 را طراحی کرد و در حال حاضر چندین مدل از این میکروسکوپ موجود است. روش E.M. برمبرگ بر این واقعیت استوار است که بسیاری از مواد تشکیل دهنده سلول ها دارای طیف جذب مشخصه اشعه UV هستند.
هنگام بررسی مواد مختلف در سلولها و بافتهای رنگآمیزی زنده یا ثابت در چنین میکروسکوپی، از آمادهسازی سه بار (در همان صفحه) در پرتوهای سه ناحیه مختلف طیف UV عکسبرداری میشود.
برای عکاسی، طول موج های UV به گونه ای انتخاب می شوند که هر ناحیه حاوی یک نوار جذبی از یک ماده باشد که در دو ناحیه دیگر اشعه را جذب نمی کند. بنابراین، موادی که در عکس ها قابل مشاهده است در همه عکس ها متفاوت است.
سپس تصاویر به دست آمده در دستگاه خاصی به نام کروموسکوپ قرار می گیرند. یک عکس به رنگ آبی، دومی سبز و سومی قرمز است.
سه تصویر رنگی به دست می آید که در کروموسکوپ با هم ترکیب می شوند و در این تصویر نهایی از جسم، مواد مختلف سلول به رنگ های مختلف رنگ می شوند.
اما میکروسکوپ فرابنفش نه تنها اجازه می دهد تا عکس بگیرد، بلکه همچنین می تواند مشاهدات بصری بافت ها و سلول ها را انجام دهد، که برای آن یک صفحه فلورسنت ویژه دارد.
با استفاده از این میکروسکوپ می توان ذراتی را که کمی کوچکتر از میکروسکوپ بیولوژیکی معمولی هستند بررسی کرد، زیرا پرتوهای UV دارای طول موج بسیار کمتری نسبت به پرتوهای نور معمولی هستند.
بنابراین، وضوح یک میکروسکوپ UV 0.11 میکرون است، در حالی که وضوح یک میکروسکوپ بیولوژیکی با استفاده از نور معمولی 0.2-0.3 میکرون است.
با استفاده از میکروسکوپ فرابنفش، تعیین کمی جذب اشعه ماوراء بنفش توسط اسیدهای نوکلئیک و سایر مواد موجود در سلول ها انجام می شود، یعنی مقدار این مواد در یک سلول تعیین می شود.
میکرو عکاسی. میکروفتوگرافی از آماده سازی های مختلف میکروسکوپی به منظور به دست آوردن تصویر بزرگ شده آنها - میکروفتوگرافی انجام می شود. مطالعه ساختارهای جداگانه سلول ها و سایر اشیاء در میکروعکس ها راحت است. میکروفوتوگرافی ها اسنادی هستند که تمام جزئیات ساختار یک نمونه میکروسکوپی را به دقت منعکس می کنند.
آماده سازی میکروسکوپی با استفاده از دستگاه های میکروفوتوگرافی مخصوص یا دوربین های پیوست میکروفوتوگرافی عکسبرداری می شود. دومی به طور گسترده مورد استفاده قرار می گیرد و برای میکروسکوپ با میکروسکوپ بیولوژیکی و هر میکروسکوپ دیگری مناسب است. دوربین ضمیمه میکروفوتوگرافی دوربینی است که لنز آن برداشته شده و میکروسکوپ جایگزین آن شده است.
سیستم نوری میکروسکوپ به عنوان لنز این دوربین عمل می کند. انواع مختلفی از پیوست های میکروفوتوگرافی وجود دارد. پیوست های میکروفوتو از نوع MFN-8 بسیار راحت هستند.
همچنین یک میکروسکوپ بیولوژیکی ویژه MBI-6 با دوربین دائمی وجود دارد. MBI-6 امکان بررسی معمولی بصری آماده سازی ها و عکاسی از آنها را در نور عبوری و بازتابی، در میدان های دید روشن و تاریک، با کنتراست فاز و در نور پلاریزه را فراهم می کند.
میکروفیلم نقش مهمی در مطالعه فرآیندهای حیات سلولی دارد. برای بررسی جزئیات مهم ترین فرآیندهای رخ داده در سلول مانند تقسیم، فاگوسیتوز، جریان سیتوپلاسمی و غیره از دستگاه تایم لپس استفاده می شود.
با کمک این دستگاه میتوان فیلمبرداری تسریعشده را که معمولاً در فرآیندهای با جریان سریع استفاده میشود، یا فیلمبرداری اسلوموشن از تغییرات سلولی که با سیر کند مشخص میشوند، تولید کرد.
میکروفیلم نه تنها روشی است که به فرد امکان می دهد ساختارها و فرآیندهای مختلف در یک سلول زنده را با جزئیات مطالعه کند، بلکه روشی برای مستندسازی این فرآیندها و همه تغییرات مرتبط با آنها است.