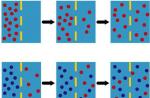
معرفی. در سال های اخیر، در ارتباط با موفقیت های ژنتیک مولکولی، که منجر به نقشه برداری و شناسایی ژن های تعداد قابل توجهی از بیماری های ارثی تک ژنی شد، مشکلاتی در ایجاد ساختار طبقه بندی آنها شروع شد. به عنوان مثال، جهش در یک ژن می تواند هم به تظاهر اشکال بالینی یک بیماری با شدت متفاوت (ناهمگنی آللی) و هم منجر به ظهور تظاهرات بالینی مختلف اشکال nosological (به اصطلاح "سری آللی") شود. یکی از گروه های بیماری های تشکیل دهنده سری آللی، لامینوپاتی ها هستند. آنها به دلیل جهش در ژن LMNA ایجاد می شوند که منجر به تغییر در ساختار و عملکرد پروتئین لامین A / C می شود (لامینوپاتی ها بیماری هایی هستند که در نتیجه جهش در ژن های پروتئین لایه هسته ای ایجاد می شوند - به زیر مراجعه کنید).
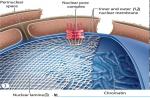
مشخص است که پوسته هسته سلولی شامل سه جزء اصلی است (شکل را ببینید): 1 ] غشای خارجی، [ 2 ] غشای داخلی و [ 3 ] صفحه نازک هسته ای که در زیر آن قرار دارد - لایه هسته ای (صفحه: lat. - lamina)، که توسط کمپلکس های پروتئینی تشکیل شده است که شامل گروه های مختلفی از لامین ها (پروتئین های لامین - زیر را ببینید). رشتههای لامین دایمرهای ابرپیچپیچ موازی را تشکیل میدهند که برای تشکیل یک شبکه رشتهای در سمت نوکلئوپلاسمی غشای هستهای داخلی، پلیمریزه میشوند و کمپلکسهای چندپروتئینی غشای هستهای درونی و بیرونی را لنگر میاندازند (توجه: لامینها یک رشته میانی کلاس 5 هستند که در همه سلولهای یوکاریوتی یافت میشوند. در تمام سلول های دارای هسته تشکیل شده).

بنابراین، لامین ها پروتئین های ساختاری هستند (دارای جرم 60 - 89 کیلو دالتون)، اجزای لایه هسته ای (لامینای هسته ای) - یک شبکه پروتئینی که در زیر غشای داخلی هسته قرار دارد و اندازه و شکل آن را تعیین می کند (یعنی در مکانیکی شرکت می کند. چسبندگی و تعامل بین اسکلت هسته و پروتئین های اسکلت سلولی). لایه هسته ای به پوشش هسته ای و سازماندهی منافذ هسته ای استحکام می دهد، در برابر نیروهای تغییر شکل مقاومت می کند و کروماتین را از آسیب فیزیکی محافظت می کند. همانطور که توسط مطالعات اخیر نشان داده شده است، همراه با عملکرد ساختاری، لامین ها در کنترل تکثیر DNA، سازماندهی کروماتین، و در تنظیم بیان ژن، پردازش و آپوپتوز نقش دارند.
همانطور که در بالا ذکر شد، لایه هسته ای از چهار پروتئین لامین تشکیل شده است: A، B1، B2 و C. لامین های B1، B2 (همچنین لامین های نوع B نیز نامیده می شوند) توسط دو ژن LMNB1 و LMNB2 (واقع در کروموزوم های 5q23 و 19q13) کدگذاری می شوند. به ترتیب) و در تمام سلول های جانوران چند سلولی سنتز می شوند. لامینهای A و C (به اصطلاح لامینهای نوع A [یا لامین A/C]) محصولات پیوند جایگزین یک ژن LMNA هستند (واقع در اولین کروموزوم 1q21.2-q21.3 و متشکل از 12 اگزون) و در مقادیر قابل مقایسه در بافت های تمایز یافته همه مهره داران، از جمله. شخص
پست رو هم بخون: نامگذاری کروموزوم های انسانی(به وب سایت)
توجه داشته باشید! مطالعات اخیر زمینه ای را فراهم می کند که لامین ها را به عنوان یکی از پروتئین های اصلی در نظر بگیریم که همزمانی پوسیدگی و ترمیم غشای هسته ای را در طول تقسیم سلولی تضمین می کند. نشان داده شده است که در پروفاز تقسیم سلولی، لامین ها فسفریله می شوند که منجر به تجزیه آنها می شود که سیگنالی برای تخریب پوشش هسته ای است. در مقابل، لامین ها در تلوفاز دفسفریله می شوند که منجر به تجمع آنها می شود. اعتقاد بر این است که فرآیند رپولاریزاسیون لامین باعث ترمیم پوشش هسته ای می شود. این توسط داده هایی پشتیبانی می شود که در پروفاز چرخه سلولی، اتصال لامین ها با قطعات غشای متلاشی شده هسته ای حفظ می شود و آنها نوعی "برچسب" برای قطعات غشای هسته ای در طول بازسازی آن هستند.
بنابراین، وظایف اصلی لامین ها عبارتند از: 1 ] 1 نقش کلیدی در حفظ شکل و یکپارچگی پوشش هسته ای. [ 2 ] سازماندهی و توزیع کروماتین منافذ هسته ای. [ 3 سازماندهی فضایی فرآیندهای تکثیر و رونویسی DNA، رویدادهای میتوزی و آپوپتوز. [ 4 ] مشارکت در مسیرهای سیگنالینگ مختلف. [ 5 ] سازماندهی ژنوم.
جهش های ژن LMNA مسئول ایجاد بیش از دوازده بیماری به نام لامینوپاتی هستند که بر بافت های مختلف هم به صورت مجزا (عضله اسکلتی و میوکارد، بافت چربی، اعصاب محیطی) و هم به صورت سیستمیک (سندرم پیری زودرس) تأثیر می گذارند. فنوتیپ های همپوشانی نیز ذکر شده است. همراه با تنوع بالینی گسترده، ناهمگنی ژنتیکی برجسته نیز مشخصه است.
توجه داشته باشید! تا به امروز، جهش در ژن LMNA (کد کننده لامین های نوع A [لامین A/C]) به عنوان یک عامل اتیولوژیک 11 نشان داده شده است. ! ) اشکال nosological مستقل که بخشی از پنج گروه بیماری های ارثی هستند - دیستروفی های عضلانی پیشرونده، کاردیومیوپاتی های گشاد شده، لیپودیستروفی ها، نوروپاتی های حسی حرکتی ارثی و سندرم های پیری زودرس. اغلب، جهش در ژن LMNA منجر به آسیب به ماهیچههای اسکلتی، میوکارد و بافت چربی میشود؛ در موارد بسیار کمتر، این جهشها عاملی سببشناختی در سندرمهای پروژروئید، نوروپاتیهای ارثی و درموپاتی محدودکننده کشنده هستند. در عین حال، سندرم های فوق می توانند به دلیل جهش هم در ژن های خود لامین ها و هم در ژن های پروتئین های شریک (SREBP1، emerins) و آنزیم های دخیل در پردازش لامین ها ایجاد شوند.
 توجه داشته باشید: MD ED - دیستروفی عضلانی Emery-Dreyfuss; KP MD - دیستروفی عضلانی اندام-کمربند. MD - دیستروفی عضلانی؛ DCMP - کاردیومیوپاتی متسع؛ KMP - کاردیومیوپاتی؛ AD - وراثت اتوزومال غالب؛ AR - توارث اتوزومال مغلوب
توجه داشته باشید: MD ED - دیستروفی عضلانی Emery-Dreyfuss; KP MD - دیستروفی عضلانی اندام-کمربند. MD - دیستروفی عضلانی؛ DCMP - کاردیومیوپاتی متسع؛ KMP - کاردیومیوپاتی؛ AD - وراثت اتوزومال غالب؛ AR - توارث اتوزومال مغلوب 
مکانیسم دقیق توسعه بیماری های مرتبط با لامین هنوز به طور دقیق مورد مطالعه قرار نگرفته است. دو فرضیه اصلی برای توضیح فنوتیپ های پاتولوژیک مشاهده شده غالب است: فرضیه ساختاری و فرضیه "بیان ژن". طبق اولی، فقدان لامین یا مونتاژ نادرست پروتئین های لامین جهش یافته منجر به کاهش قدرت لایه هسته ای و افزایش آسیب پذیری هسته و سلول به طور کلی می شود. اول از همه، سلول هایی که تحت فشار مکانیکی قرار می گیرند، مانند سلول های عضلانی و کاردیومیوسیت ها، با ایجاد تغییرات دژنراتیو رنج می برند. فرضیه دوم حاکی از اختلال در رابطه بین لایه هسته ای و عوامل رونویسی است. اخیراً فرضیه دیگری فرموله شده است که بر اساس آن جهش لامین های A/C یا عدم وجود لامین های نوع A می تواند مکانیسم سوم پاتوژنز - جداسازی موقت (به دلیل اختلال در یکپارچگی غشای هسته) را تحریک کند. تبادل ناکافی بین اجزای هسته ای و سیتوپلاسمی
اطلاعات بیشتر در مورد بیماری های مرتبط با لامین را در منابع زیر بخوانید:
مقاله "ویژگی های بالینی و ژنتیکی لامینوپاتی های ارثی" E.L. دادالی، د.س. بیلوا، I.V. اوگاروف مرکز علمی ژنتیک پزشکی آکادمی علوم پزشکی روسیه، مسکو؛ گروه ژنتیک، دانشکده پزشکی و زیستشناسی، دانشگاه پزشکی دولتی روسیه، مسکو (مجله "سالنامههای عصبشناسی بالینی و تجربی" شماره 4، 2008) [خواندن];
مقاله "جهش ژن لامین A/C (LMNA) در بیماران مبتلا به کاردیومیوپاتی گشاد شده و تظاهرات فنوتیپی آنها" Vaykhanskaya T.G., Sivitskaya L.N., Danilenko N.G., Kurushko T.V., Davydenko O.G. مرکز علمی و عملی جمهوری خواه "کاردیولوژی"، گروه عملکردی پاتوفیزیولوژی بالینی گردش خون، مینسک، بلاروس؛ مؤسسه علمی دولتی "موسسه ژنتیک و سیتولوژی"، آکادمی ملی علوم، آزمایشگاه توارث غیر کروموزومی، مینسک، بلاروس (مجله قلب و عروق اوراسیا، شماره 1، 2016) [خواندن]؛
پایان نامه برای درجه کاندیدای علوم پزشکی "تنوع بالینی و ژنتیکی و تشخیص مولکولی دیستروفی عضلانی Emery-Dreyfus" Adyan Tagui Avetikovna، FGBNU "مرکز تحقیقات ژنتیک پزشکی"، مسکو، 2015 [خواندن]؛
ارائه "Progeria - سندرم پروگریا هاچینسون-گیلفورد (HGPS)" S. Kokorin, E. Podkhalyuzina, V. Smirnov; سمینار زیست شناسی مولکولی; 2010/12/25 (bioinformaticsinstitute.ru) [خواندن]؛
مقاله "لیپودیستروفی جزئی خانوادگی (سندرم دانیگان) به دلیل جهش در ژن LMNA: اولین توصیف یک مورد بالینی در روسیه" E.L. سورکین، M.F. کلاشینکف، G.A. ملنیچنکو، A.N. تولیپاکوف؛ گروه غدد درون ریز، دانشکده پزشکی، SBEI HPE "اولین دانشگاه پزشکی دولتی مسکو به نام I.I. آنها سچنوف» از وزارت بهداشت روسیه، مسکو؛ موسسه بودجه ایالت فدرال "مرکز تحقیقات غدد درون ریز" وزارت بهداشت روسیه، مسکو (مجله "آرشیو درمانی" شماره 3، 2015) [خواندن]
© Laesus De Liro
نتایج مرحله: 1) تجزیه و تحلیل محتوای لامین A و لامین B در پوشش هسته سلول های انتخاب شده در مرحله اول خطوط کاری (فیبروبلاست های همستر تبدیل شده با Ras با پتانسیل متاستاتیک متفاوت). در تمام رده های سلولی، آنتی بادی های هر دو لامین، هسته ها را به خوبی رنگ می کنند. در سلولهای HET-SR (با متاستاز کم)، هستهها شکل منظمی دارند، لامین A هم در پوشش هسته و هم در نوکلئوپلاسم شناسایی میشود، لامین B روشنتر است که عمدتاً در غشای هسته وجود دارد. همه رده های سلولی بسیار متاستاتیک، طیف گسترده ای از اشکال هسته ای، و همچنین تشکیل چین ها یا تجمعات ناهموار لامین ها را نشان می دهند (شکل 1). در سلولهایی که بهطور خودبهخود تبدیل شدهاند، که در آنها تغییر شکل در نتیجه کشت طولانیمدت آزمایشگاهی رده سلولی جنینی همستر سوریه (ST-HET - سلولهای با متاستاز کم، ST-HET کلون 83/20 - سلولهای با متاستاز بالا) رخ داده است. ، تغییرات مشابهی مشاهده شد - در غیاب تفاوت معنی داری در لامین های A و B با شدت رنگ آمیزی بین خطوط با متاستاتیک کم و زیاد، تغییر زیادی در شکل هسته ها در کلون ST-HET بسیار متاستاتیک 83 مشاهده شد. /20 خط و توزیع ناهموار هر دو لامین (شکل 2). آنالیز وسترن بلات بیان لامین نیز تفاوت معنی داری را در محتوای لامین های A و B بین سلول های با متاستاز کم و زیاد نشان نداد (شکل 3). از آنجایی که تفاوت در فعالیت متاستاتیک in vivo ممکن است به فعالیت متالوپروتئازهای ماتریکس بستگی داشته باشد، تجزیه و تحلیل زیموگرافی در خطوط مورد مطالعه انجام شد. برای انجام این کار، سلول ها بر روی ظروف پتری 35 میلی متری با غلظت 150000 سلول در هر ظرف کاشته شدند، به مدت 1 روز کشت داده شدند، سپس 3 بار با محیط بدون سرم شسته و به مدت 12 ساعت در محیط بدون سرم قرار داده شدند و محیط تهویه شده. جمع آوری شد. پس از آن، تعداد سلول ها در ظروف شمارش شد تا کاربرد پروتئین در مطالعه فعالیت متالوپروتئینازها عادی شود. برای تجزیه و تحلیل فعالیت ژلاتیناز متالوپروتئازهای ماتریکس، مقدار 10 میکرولیتر از محیط مطبوع با 10 میکرولیتر از بافر بارگیری پروتئین زیموگرافی مخلوط شده و روی ژل اعمال شد. الکتروفورز استاندارد SDS-PAGE در شرایط استاندارد در یک ژل پلی آکریل آمید 8 درصد حاوی 2/0 درصد ژلاتین انجام شد، بازسازی مجدد به مدت 30 دقیقه و واکنش ژلاتیناز به مدت 4 ساعت انجام شد. برای تمام لاین های مورد مطالعه، فعالیت متالوپروتئیناز 2 مشاهده شد، با این حال، تفاوت معنی داری در فعالیت متالوپروتئینازها بین سلول های متاستاتیک کم و زیاد وجود نداشت (شکل 4). بنابراین، تفاوت در پتانسیل متاستاتیک سلول های همستر سوریه تحت روش های مختلف تبدیل به دلیل تغییر در محتوای لامین A یا لامین B نیست، بلکه با تغییر در شکل هسته ها و توزیع لامین ها همراه است. که نشان دهنده اختلالات احتمالی هم در هدف قرار دادن لامین ها به غشای هسته ای داخلی و هم در تنظیم مونتاژ میکرو دامنه های لامین است. 2) تجزیه و تحلیل فعالیت مهاجرت سلول ها در یک فضای محدود. فعالیت مهاجرت سلولی بسته به سطح بیان لامین A و انواع اسپلایس آن در محفظه های بویدن با قطر منافذ 3 و 8 میکرومتر انجام شد. برای ایجاد یک گرادیان شیمیکشنده، سرم جنین به محفظه پایینی اضافه شد و سلولهای اتاق فوقانی در محیطی بدون سرم انکوبه شدند (شکل 5). تجزیه و تحلیل بر روی جمعیت های سلولی از خط HT1080 (فیبروسارکوم انسانی)، ناهمگن از نظر سطح بیان GFP-lamin A و GFP-progerin، و همچنین سلول هایی با ناک داون لامین A (سطح شکست در سلول های فردی) انجام شد. متناسب با فلورسانس GFP است که با RNA سنجاق سر در برابر لامین A بیان می شود. تجزیه و تحلیل کارایی مهاجرت روز بعد پس از کاشت با استفاده از غربالگری میکروسکوپی با توان بالا و تشخیص خودکار تعداد سلولها با سطح سیگنال GFP بالاتر از آستانه در دو طرف غشا با استفاده از الگوریتمهای بهینهسازی شده در مرحله قبلی پروژه انجام شد. نتایج تجزیه و تحلیل نشان داد که نسبت سلولهایی که هم لامین A و هم پروگرین خارجی را بیان میکنند در جمعیت سلولهایی که از طریق منافذ مهاجرت کردهاند به طور قابلتوجهی کاهش مییابد که نشاندهنده مهار مهاجرت است (شکل 6). این تأثیر به اندازه منافذ بستگی دارد: راندمان مهاجرت از طریق منافذ 8 میکرومتری به ترتیب 25٪ و 32٪ برای لامین A و پروگرین کاهش می یابد و هنگام مهاجرت از طریق منافذ 3 میکرومتر، راندمان حتی به میزان قابل توجهی کاهش می یابد - 61 درصد و 66 درصد. در عین حال، سرکوب بیان لامین A منجر به فعال شدن مهاجرت نمی شود (شکل 7). ظاهراً، از آنجایی که سلولهای تبدیل شده با پتانسیل مهاجرت اولیه بالا و پلاستیسیته بالای پوشش هستهای در این مطالعات مورد استفاده قرار گرفتند، کاهش اضافی در سطح لامین A به طور قابلتوجهی به توانایی سلولها برای مهاجرت از طریق منافذ کمک نمیکند. بنابراین، در مرحله بعدی آزمایش ها، برنامه ریزی شده است که از خطوط HSR شرح داده شده در گزارش قبلی استفاده شود که احتمالات متفاوتی را برای متاستاز (تهاجم به بافت های بدن) و همچنین انواع تراریخته آن ها نشان می دهد. 3). برای مطالعه مهاجرت سلولی در ژل کلاژن سه بعدی، یک الگوریتم تصویربرداری میکروسکوپ روشنایی مسطح بهینه شده (SPIM) به طور مشترک توسط PhaseView توسعه داده شد. این الگوریتم و اجرای سختافزاری آن، میکروسکوپ نوری سهبعدی مسطح نوری (SPIM) را با یک صفحه نور لیزری با افزایش یکنواختی و عمق انتشار در کل میدان دید در نمونههای شفاف و شفاف با اندازه متوسط تا بزرگ ارائه میکند. به طور خاص، این سیستم ابزاری را برای حفظ حداقل ضخامت ورق نور لیزر در داخل جسم در حداکثر منطقه ممکن برای یک پیکربندی نوری مشخص فراهم میکند که وضوح محوری یکنواخت و حداکثر ممکن را در سراسر میدان دید فراهم میکند. این سیستم بر اساس همگام سازی سرعت و فاز شاتر نورد یک دوربین CMOS است که برای ضبط تصویر با حرکت زین ورق لیزری با استفاده از اپتیک تطبیقی نصب شده در مسیر نوری تحریک (شکل 8) استفاده می شود. این سیستم به طور خاص برای تجزیه و تحلیل مهاجرت سلولی در ژل سه بعدی اقتباس شده است، زیرا SPIM در مقایسه با میکروسکوپ کانفوکال لیزری اسکن نقطهای، سمیت نوری کاهشیافته و نرخهای دریافت تصویر را بهطور قابلتوجهی سریعتر ارائه میکند و مشاهدات طولانیمدت in vivo را در حالی که حجم نمونه بهطور قابلتوجهی بزرگتر را تجزیه و تحلیل میکند، امکانپذیر میسازد. وضوح مکانی و زمانی بالا (شکل 9). این سیستم بیشتر برای تجزیه و تحلیل اثر مهار Zmpste24 بر فعالیت مهاجرت سلول های سرطانی در ژل های سه بعدی مورد استفاده قرار خواهد گرفت. 4) تأثیر بیان لامین اگزوژن A و پروگرین بر روی خواص مکانیکی پوشش هسته ای در سلول های زنده با استفاده از میکروسکوپ یون رسانا روبشی (SICM) تجزیه و تحلیل شد. این روش علاوه بر امکان اسکن با سرعت بالا برجستگی سطحی سلول های زنده کشت شده با قدرت تفکیک جانبی و محوری بالا، امکان اندازه گیری خواص کشسانی سلول ها را فراهم می کند (شکل 10a, b). اندازه گیری ضرایب الاستیسیته هسته نیز به دلیل وجود لایه نازک سیتوپلاسم در بالای هسته سلول که روی یک بستر شیشه ای پخش شده است امکان پذیر است. برای به حداقل رساندن سهم سیتوپلاسم در پارامترهای تعیینشده هسته، از سلولهای فیبروسارکوم انسانی HT1080 استفاده شد که درجه بالایی از انتشار را نشان میدهد. سلول ها با یک پلاسمید کد کننده GFP-lamin A یا GFP-progerin ترانسفکت شدند. اندازهگیریها بر روی یک ابزار MNT (Medical Nanotechnologies LLC) نصب شده بر روی پلت فرم فلورسنت معکوس Eclipse Ti2 (Nikon) در روز دوم پس از ترانسفکشن انجام شد. یک میکروپیپت شیشه ای روی یک کنترل کننده پیزو به عنوان یک عنصر اسکن استفاده شد (شکل 10، a). سلول ها برای اسکن با توجه به سطح فلورسانس در کانال GFP انتخاب شدند. ابتدا برجستگی سلول مورد مطالعه اسکن شد. در این حالت، سطح زمانی تشخیص داده میشود که با رسیدن به مرز آن با یک میکروپیپت شیشهای، قدرت جریان یونی 0.25-1٪ کاهش یابد. سپس سفتی موثر تعیین شد که از جابجایی نهایی ثبت شده غشاء پس از پانچ شدن توسط جریان یونی محاسبه شد؛ در این حالت، نقطه بعدی کاهش جریان یونی به میزان ~1٪ تعیین شد. کل سلول اسکن شد، سپس موقعیت هسته با بالاترین نقطه روی برجسته تعیین شد. در این ناحیه، 10 نقطه برای پردازش گرفته شد، مقادیر سفتی برای 10 نقطه دیگر در امتداد محیط سلول انتخاب شد، در حالی که این نقاط نباید خیلی نزدیک به لبه سیتوپلاسم قرار گیرند، به طوری که مقادیر سفتی وجود داشته باشد. زیرلایه در نمونه گنجانده نمی شود (شکل 10c). نتایج اندازه گیری کشش هسته به کشش سیتوپلاسم در ناحیه لاملا نرمال شد. در تعدادی از آزمایشها، اندازهگیریها در برابر پسزمینه جداسازی اسکلت سلولی اکتین و توبولین (تحت تأثیر نوکودازول و سیتوکالاسین D) انجام شد، درجه جداسازی با رنگآمیزی سلولها با آنتیبادیها علیه بتا توبولین یا رنگآمیزی داخل حیاتی ارزیابی شد. با SIR-اکتین. نتایج اولیه یک ارتباط مستقیم بین غلظت GFP-lamin A خارجی در هسته و سفتی هسته سلول را نشان داد (شکل 11). تحقیقات برای بهینه سازی روش (انتخاب قطر مویرگی، اصلاح الگوریتم های محاسبه سختی و غیره) به منظور بهبود دقت اندازه گیری ها، افزایش حجم نمونه و همچنین بررسی اثربخشی بازدارنده های Zmpste24 ادامه خواهد داشت. 5). مطالعه تأثیر بیان پروگرین بر سازماندهی ساختاری و موقعیت هتروکروماتین محیطی بر روی مدلی از ردههای سلولی همستر چینی (CHO) انجام شد که در ژنوم آن یک مکان کروموزومی مصنوعی حاوی چندین تکرار پشت سر هم از اپراتور Lac انجام شد. یکپارچه شود. تصویربرداری جایگاه با استفاده از سرکوبگر GFP-Lac بیان شده در سلول ها انجام شد (Robinett et al, 1996). ما از کلون AO_3 حاوی یک منبع مصنوعی تقویتشده (HSR) استفاده کردیم که درجه بالایی از هتروکروماتین شدن را نشان میدهد و به طور دائم با لایه هستهای مرتبط است (لی و همکاران، 1998؛ ژیرونکینا و همکاران، 2014). سلولهای CHO AO_3 با پلاسمید کدکنندهی GFP-progerin ترانسفکت شدند، پس از 48 ساعت سلولها ثابت و با آنتیبادیهای ضد لامین A رنگآمیزی شدند تا سیگنالهای سرکوبگر GFP-Lac و GFP-progerin را متمایز کنند. ایمونوفلورسانس و میکروسکوپ با وضوح فوق العاده نشان داد که بیان پروگرین باعث کاهش درجه تراکم نمی شود، همانطور که با تغییرات در ناحیه HSR یا میانگین شدت فلورسانس GFP در آن ارزیابی می شود (شکل 12). همچنین، هیچ تغییر قابل توجهی در موقعیت HSR نسبت به پوشش هسته ای وجود نداشت: در سلول هایی با سطح بیان بالای پروگرین، ساختار لوبولی هسته معمولی پروگریا هاچیسون-گیلفورد و تشکیل هجوم های متعدد هسته ای. غشاء آشکار می شود، و HSR همیشه یا با محیط هسته یا با لامین ها در نواحی انواژشن همراه باقی می ماند. برای مطالعه سازمان فراساختاری کروماتین در سلولهایی که GFP-progerin را بیان میکنند، از میکروسکوپ ایمونوالکترونی با آنتیبادیهای ضد GFP و به دنبال آن تقویت Ag سیگنال آنتیبادیهای ثانویه نشاندار شده با Nanogold استفاده کردیم. این رویکرد امکان شناسایی سلول های ترانسفکت شده در سطح نوری- نوری را با استفاده از میکروسکوپ نوری میدان روشن و یافتن کارآمد آنها در مقاطع بسیار نازک فراهم کرد. تجزیه و تحلیل الکترونی میکروسکوپی نشان داد که هر دو مکان کروموزومی مصنوعی و مناطق هتروکروماتیک درون زا کروموزوم ها، برخلاف فرضیه هایی که قبلا بیان شد، ساختار متراکم خود را حفظ می کنند. با این حال، در این مورد، اغلب از دست دادن ارتباط هتروکروماتین محیطی با لایه هسته و حرکت آن به مناطق داخلی هسته وجود دارد (شکل 13، a). مناطق قابل توجهی از لایه هسته ای تحت این شرایط عاری از تماس با هتروکروماتین باقی می مانند (شکل 14). 6). شناسایی دامنه امیدوارکنندهترین بازدارندههای رقابتی با استفاده از روشهای مدلسازی مولکولی، مطالعه بیشتر پایداری کمپلکسهای آنزیم-بازدارنده با روشهای دینامیک مولکولی به منظور انتخاب ترکیبات کاندید برای مطالعه تجربی.برای ZMPSTE24، اطلاعات ساختاری توسط کریستالوگرافی تعیین شد. دادههای آنزیم و پروتئین نوترکیب انسانی از Saccharomyces cerevisiae Ste24p در همان زمان، تنها یک ساختار از مجموعه ZMPSTE24 با یکی از مهارکنندههای متالوپروتئازهای محلول وابسته به روی، که مهار رقابتی ضعیفی از ZMPSTE24، فسفورامیدون را فراهم میکند، شناخته شده است، که با وضوح کم روش کریستالوگرافی مشخص میشود. علیرغم شباهت سایت فعال ZMPSTE24 با برخی از متالوپروتئازهای وابسته به روی، مانند ترمولیزین و نپری لیزین، اتصال فسفورامیدون در سطح قابل توجهی پایین تر ارائه شد. زیرا آزمایشها در شرایط آزمایشگاهی انجام شد، شواهد مستقیمی مبنی بر اثربخشی این دسته از مهارکنندهها به عنوان دارو شناسایی نشده است. انتظار اثربخشی in vivo در حال حاضر با هیچ روشی پشتیبانی نمی شود، علاوه بر این، تحویل چنین ترکیباتی ممکن است با ورود پیچیده به سایت فعال ZMPSTE24 که توسط رابط برهمکنش آنزیم-لیپید-آب تشکیل شده است، مانع شود، همانطور که در قبلی توضیح دادیم. مرحله کار در سال 2017 از سوی دیگر، مشخص شده است که دسته ای از مولکول های مورد استفاده در درمان ضد رتروویروسی در بیماران HIV می توانند در نتیجه اتصال خارج از هدف این مولکول ها به ZMPSTE24، لیپودیستروفی را در آنها ایجاد کنند. در همان زمان، لوپینوویر مؤثرترین بود، که برای آن مکانیسم رقابتی مهار ZMPSTE24 به طور تجربی نشان داده شد. با توجه به محدودیت های توصیف شده، استفاده از طرح کلاسیک در سیلیکو برای غربالگری کتابخانه های ترکیبات شیمیایی، که معمولاً شامل شمارش تعداد زیادی از ساختارهای تصادفی یا سنتز شده فعلی مولکول های آلی و اتصال بعدی آنها به ساختار کریستالوگرافی استاتیک ZMPSTE24، به نظر می رسد بی اثر باشد. ساختار ZMPSTE24 یک شکل نسبتاً منحصر به فرد است که توسط هفت مارپیچ گذرنده تشکیل شده است که یک حفره داخلی 14000 آنستروم مکعبی پر از آب را در یک لایه دولایه لیپیدی قرار داده است. اکثر برنامههای Docking مدرن در محاسبات خود تنها از شکل ضمنی یک محلول آبی هنگام محاسبه انرژیهای اتصال استفاده میکنند و نمیتوانند تأثیر لایه دوتایی لیپیدی را در نظر بگیرند. استفاده از ساختارهای استاتیک ZMPSTE24 تعبیه شده در یک دولایه نمی تواند ویژگی پاکت های تشکیل شده در سطح مشترک آنزیم-لیپید-آب، و همچنین ویژگی های دینامیکی آنها را در نظر بگیرد - مدل لایه لیپیدی تحرک بالایی از بخش آبگریز را در نظر می گیرد. مولکول های دولایه در مقایسه با آرایش حفره ها و پاکت های پروتئین های ساختاری پایدار. ترکیبی از این عوامل منجر به ناکارآمدی روش جستجوی بازدارنده محبوب مانند مطالعات رابطه ساختار-فعالیت (SAR) سازگار با مدلهای حلال آبی خالص میشود. منطقیترین راه در این مورد شامل استفاده از ساختار اساسی مولکولها است که پتانسیل آن قبلاً در آزمایشهای in vitro و in vivo نشان داده شده است، به عنوان نقطه شروعی برای جستجوی تغییراتی که معرفی آنها باعث بالا رفتن میشود. کارایی الزام آور در حال حاضر، بهترین کاندیدها پپتیدومیمتیک های مصنوعی هستند که در مهار پروتئازهای آسپارتات، از جمله. و پروتئاز HIV به منظور جستجوی مکانیسم عمل این دسته از مولکولها، که هنوز برای ZMPSTE24 ناشناخته است، یک روش در سیلیکو برای جستجوی مکانهای اتصال، و همچنین راههای تحویل مولکولها از محلول، با در نظر گرفتن هر دو آنزیم، توسعه دادیم. رابط لیپید-آب و ساختار دینامیکی خود آنزیم و غشای اطراف. این روش مبتنی بر کاربرد مدلسازی دینامیک مولکولی در ترکیب با روش متادینامیک توسعهیافته است (به زیر مراجعه کنید). اهمیت این رویکرد به این دلیل است که در ادبیات قبلاً تلاشی برای اصلاح ساختارهای پپتیدومیمتیک های پروتئاز HIV، بر اساس فرضیه یک عمل مکانیکی مشترک پروتئازهای آسپارتات و پروتئازهای محلول وابسته به روی صورت گرفته است. بر اساس قیاس، مکانیسم برای ZMPSTE24 پیشنهاد شد. در عین حال، این فرضیه توسط هیچ مطالعه ساختاری تایید نشده است. در جریان مطالعه ما، مکانیسم کاملاً جدیدی از عملکرد پپتیدومیتیک های پروتئاز HIV کشف شد که تعدادی از ویژگی ها و ایده ها را برای طراحی منطقی یک مهارکننده موثر ZMPSTE24 باز می کند. الگوریتم توسعهیافته برای ایجاد توزیع حالتهای ساختاری احتمالی و انواع اتصال لوپینوویر نسبت به کل سطح ZMPSTE24 غوطهور در دولایه لیپیدی و همچنین در حفره داخلی آن و در فاصلهای از سطح در ضخامت استفاده شد. محلول، هم آبی و هم لیپیدی. این امر امکان ارزیابی پر انرژی اتصال لوپینوویر در تمام محلهای اتصال بالقوه، و همچنین موانع بین آنها و مسیرهای مهاجرت احتمالی از یک حلال خارجی را ممکن میسازد. نقشه های انرژی مشابه نسبت به سه مختصات فضای فاز ساخته شده و به صورت برش هایی بر روی مقادیر فردی یکی از متغیرها و سطوح هم سطح ارائه می شوند (شکل 1.2). آن ها برای تفسیر نقشه های انرژی چند بعدی به دست آمده، استفاده از مقادیر ثابت تنها یک متغیر راحت است، به عنوان مثال، فاصله مرکز جرم لوپینوویر از مرکز جرم آنزیم، اما برای ترسیم توزیع های نسبت به دو متغیر دیگر، θ و φ زاویه ای. تجزیه و تحلیل نشان می دهد که نفوذ لوپینوویر از محلول آبی به غشاء به دلیل وجود یک مانع دشوار است. این سد در نتیجه ویژگیهای ساختاری دولایه لیپیدی ایجاد میشود: بخشهای باردار فسفولیپیدها که غشا را تشکیل میدهند - فسفاتیدیل کولین و فسفاتیدیل اتانول آمین به سمت محلول آبی جهتگیری میکنند و یک پتانسیل سطحی دوقطبی را تشکیل میدهند که در مرحله اولیه عبور لوپینوویر به غشاء مانعی ایجاد می کند، هم فضایی و هم احتمالاً آنتروپی مشاهده شده در سیستم های لیپید آب. زیرا از آنجایی که لوپیناویر یک ترکیب آبگریز است، ورود آن به لایه لیپیدی به خودی خود یک فرآیند مفید است. با این حال، مسیر غلظت آن در غشاها از مانع تشکیل شده توسط پتانسیل سطح دوقطبی می گذرد. در عین حال، می توان مشاهده کرد که نفوذ لوپیناویر به غشاء از نظر انرژی در محدوده 60 مطلوب تر است.<θ<75 и -160<φ<-180. Эта область соответствует границе липидной мембраны с водным раствором над входом во внутреннюю полость ZMPSTE24, используемым белковым субстратом для проведения каталитического протеолиза. Детальное исследование этой области в процессе молекулярной динамики позволило выявить проседание липидного бислоя вблизи входа в активный центр фермента относительно общей поверхности мембраны (Рис.3). Подобное проседание обеспечивается специфическим распределением заряда на поверхности ZMPSTE24, показанное в ходе одного из этапов работы в 2017г. По всей видимости, мы предполагаем, что проседание формирует разрыв в дипольной части бислоя и облегчает доступ гидрофобных молекул к внутренней гидрофобной части мембраны. Однако, при этом, наименьшим значением энергии соответствует связывание лопинавира на интерфейсе, образованным входом в активный центр фермента и липидным бислоем (75<θ<100 и -160<φ<-180,160<φ<180). Несмотря на возможность проникновения лопиновира во внутреннюю полость фермента, специфического взаимодействия с остатками каталитического центра или областью связывания субстрата обнаружено не было (Рис. 1). Косвенно эти результаты подтверждаются отсутствием кристаллографической структуры ZMPSTE24 в комплексе с лопинавиром в активном центре. Обнаруженный нами механизм связывания также подтверждает и ингибирование лопинавиром фермента по конкурентному типу. Мы также провели подобное исследование в системе фермент-вода без липидного слоя. Подобного типа связывания обнаружено не было (Рис. 2). Это может объяснить отсутствие электронной плотности лопинавира в кристаллах ZMPSTE24, выращенных при добавлении ингибитора, ввиду отсутствия в кристаллах упорядоченной структуры мембраны. Для установления специфических взаимодействий лопинавира в процессе связывания на входе в активный центр мы провели кластерный анализ ансамбля структур ингибитора, обнаруженных в процессе его нахождения в обнаруженном нами центре связывания. Для этого был использован непараметрический байесовский метод кластеризации по основным двугранным углам, определяющим конформацию лопинавира (см. ниже). На предмет специфических взаимодействий был использован самый населенный кластер. Ориентация и конформация лопинавира характеризуется стэкинг-взаимодействием одной из боковых фенильных групп с фениаланиновым аминокислотным остатком фермента, обеспечивающих структуру петли на входе в активный центр, плотным контактном гидрофобных групп аминокислот образующих вход спиралей фермента с боковыми гидрофобными группами лопинавира. Также гидрофобные группировки лопинавира частично остаются в липидном бислое. Кетотетрагидропиримидиновая группировка лопинавира – наиболее полярная часть ингибитора – обращена во внутренню полость фермента, наполненную молекулами воды. Таким образом, мы предлагаем данный центр связывания, как наиболее перспективный с точки зрения связывания конкурентных ингибиторов пептидомиметиков, ввиду наличия как функционально важных заряженных и гидрофобных групп фермента со специфическим паттерном распределения в пространстве, так и особым способом доставки и проникновения в мембрану. В метадинамике к основному потенциалу системы добавляется смещающий гауссов потенциал от коллективных переменных через определенные промежутки времени (формула 1). Высота ω и ширина δs гауссова потенциала и частота τG добавления этого смещающего потенциала к полному потенциалу системы, а также выбор коллективных переменных (CV) являются важнейшими параметрами при таком моделировании. Для построения полной трехмерной карты свободной энергии лопинавира при движении относительно ZMPSTE24 мы должны были подобрать такие CV, который бы описывал этот процесс наиболее точно. Каждую точку на поверхности белка в системе координат связанной с центром масс белка можно задать тремя переменными: два сферических угла θ и φ и расстояние между центром масс белка и лиганда r (Рис. 4). ZMPSTE24 представляет собой мембранный белок, содержащий структуру из трансмембранных альфа-спиралей, образующих камеру внутри белка существенного объем. Поэтому выбор именно таких трех коллективных переменных позволяет исследовать внешнюю и внутреннюю поверхности белка, а также процесс проникновения лопинавира в камеру внутри фермента. Таким образом положение лиганда относительно центра масс белка описывалось обычными сферическими координатами, которые легко перерассчитывались из декартовых компонент радиус-вектора между белком и лигандом (формула 2). Значение ω для потенциала смещения равнялось 5 кДж/моль, ширина потенциалов δsθ и δsφ выбраны 0.1 радиан и 1Å для δsr. Такой выбор этих параметров позволил плавно исследовать всю поверхность свободной энергии. При движение лопинавира от одной точки поверхности белка к другой может быть энергетически выгодно его смещение в раствор. Однако отдаление на значительное расстояние может, с одной стороны, замедлить расчеты, а с другой внести артефакты, связанные с сильным изменением радиуса. Чтобы избежать сильного удаления лопиновира от белка было введено ограничение на координационное число. Координационное число позволяет количественно охарактеризовать степень близости лиганда к белку и рассчитывается по формуле 3. Само число состоит из слагаемых sij, которые равняются 1, если атом j, в данном случае, лиганда расположен не дальше, чем на расстоянии r0 от атома белка i (то есть образует «контакт»), и в любом другом случае равно нулю. Введения ограничения на координационное число позволяет, варьируя параметр r0, контролировать расстояние, на которое ингибитор может отходить от поверхности белка. Параметры для ограничения системы по координационному числу были подобраны в ходе ряда калибровочных запусков метадинамики таким образом, чтобы лиганд имел возможность отходить от белка на расстояние, на котором между ними может оказать растворитель, но при этом достаточно малое, чтобы в случае можно было почувствовать взаимодействие с поверхностью. При сильном отдалении лопиновира от белка средства программы для метадинамики вводят дополнительную энергию таким образом, чтобы сблизить их друг с другом. Это, без дополнительного контроля, может привести к тому, что белок может начать разрушаться. Так происходит потому, что при удалении ингибитора все меньше атомов белка будут находиться в контакте с ингибитором (Рис. 5), а это, в свою очередь, приведет к тому, что системе может оказаться более выгодным начать разрушение белка вместо того, чтобы двигать лиганд в сторону поверхности. Для предотвращения такого исхода дополнительно было введено ограничение значение RMSD всех атомов основной цепи белка. Такой выбор атомов для RMSD позволил предотвратить разрушение структуры фермента, но также не стал препятствием для свободного движения аминокислотных радикалов, которое может происходить в растворе, при взаимодействии с мембраной, а также при взаимодействии с ингибитором. Молекула лопинавира не является стандартной для атомных силовых полей. Точечные заряды на атомах были рассчитаны с применением процедуры RESP. Однако, лопинавир – достаточно большая молекула, поэтому для расчета зарядов он был логично разделен на три части, которые были параметризованы по отдельности (Рис. 6). Такой подход позволил избежать возможных артефактов при расчете заряда, в связи с наличием большего количества конформеров лопинавира. Кроме того, при дальнейшем поиске новых ингибиторов на основе лопинавира, можно будет легко заменять одну или две части молекулы, используя уже известные параметры для остальных константных частей. Параметры силового поля для атомов были выбраны в соответствии с атомным силовым полем GAFF (General Amber Force Field). Молекулярно механическая энергия итоговой молекулы была сопоставлена с квантовой энергией. Сравнение показало, что молекулярно механическая модель, рассчитанные точечные заряды и выбранные параметры поля с высокой степенью точности совпадает с квантовой. Кластеризацию цельной структуры субстрата проводили на базе значений дигедральных углов между углеводными мономерами, с использованием следующей модификации: Отображение фазового пространства углов – в общем случае L-мерного бокса Pc (формула 4). Продуктом отображения является тор Te – L-мерная поверхность на единичной сфере S2L-1. Отображение является локальной изометрией с сохранением меры расстояний. Преобразованные переменные использовали для кластеризации с помощью Байесовского непараметрического метода, имплементированного в программе dpMMlowVar. Оптимизацию углового параметра для данного метода проводили в пределах [-0.6;-0.3] с шагом 0.01 на основании оценочной функции силуэт. При визуализации результатов кластеризации использовали метод главных компонент для трансформированных значений углов с выделением первых трех главных компонент. 11 Июля 2008مشکل کنترل ژنتیکی امید به زندگی و روند پیری جنبه های زیادی دارد که یکی از آنها در مطالعه بیماری های ارثی در گروه لامینوپاتی ها برجسته شد. لامینوپاتی ها گروهی از بیماری های ارثی هستند که در اثر جهش در ژن های کد کننده پروتئین لایه های هسته ای ایجاد می شوند که بخشی از پوسته هسته سلول است و نقش مهمی در حفظ سفتی آن ایفا می کند.
پوشش هسته ای شامل یک غشای هسته ای دو لایه، متشکل از لایه های بیرونی و داخلی، مجموعه ای از منافذ هسته ای و یک لایه هسته ای است که در زیر سطح غشای هسته ای داخلی قرار دارد. در ابتدا، لامینا به عنوان یک جزء فیبری هسته، متشکل از رشته هایی با اندازه رشته های میانی (10-13 نانومتر) یافت شد [رشته های میانی (IF) عناصری از ساختارهای اسکلت سلولی موجودات چند سلولی هستند و هر دو در سیتوپلاسم یافت می شوند. و در هسته]. ویژگی های ساختاری رشته های لامینا توسط پروتئین هایی که آنها را تشکیل می دهند، به نام لامین تعیین می شود.
لامین ها به ابرخانواده پروتئین IF، گروه 5 تعلق دارند (4 گروه باقیمانده سیتوپلاسمی هستند) و به دلیل ویژگی های ساختاری خود، قادر به تغییر پس از ترجمه هستند. تعداد پروتئین های لامین موجود در متازوئن های مختلف متفاوت است. انسان ها (و سایر پستانداران) دارای 3 ژن هستند که 7 پروتئین مختلف را کد می کنند. این پروتئین ها به دو نوع تقسیم می شوند - نوع A و نوع B، که از نظر کنترل ژنتیکی، روش سنتز، الگوی بیان و سایر ویژگی ها متفاوت هستند (جدول 1 - طبق نظر C.J. Hutchison، 2002 با تغییرات).
|
نوع لامین |
اصطلاح |
|||
|
A، AD10 *، C |
LMNA |
پیوند جایگزین |
سلول های تمایز یافته |
|
|
LMNA |
پیوند جایگزین |
ژرملاین (بیان خاص اسپرم) |
||
|
LMNB 1 |
محصول ژن LMNB 1 |
اکثر سلول ها |
||
|
LMNB2 |
پیوند جایگزین |
اکثر سلول ها |
||
|
LMNB2 |
پیوند جایگزین |
فقط در اسپرماتوسیت ها |
* - این لامین در برخی از رده های سلولی تومور نیز یافت شد.
[پیشگیری جایگزین، «تغییر شکل» کنترلشده مولکولهای RNA پیامرسان (mRNA) است که از یک ژن خوانده میشود، همراه با پیوستن اگزونهای ژن در ترکیبهای مختلف با تشکیل مولکولهای مختلف mRNA بالغ، این تضمین میکند که یک ژن محصولات نهایی مختلف را کد میکند. یکی از مکانیسم های اصلی برای ایجاد تنوع پروتئین در یوکاریوت های بالاتر است.]
لامین های B1 و B2 در اکثر سلول ها در جنین و بالغ بیان می شوند. یکپارچگی هسته، بقای سلول و رشد طبیعی به آنها بستگی دارد. لامین های نوع A الگوی بیان متفاوتی دارند که با تمایز سلولی مرتبط است. این به این پیشنهاد منجر شد که لامین های نوع B میزان زنده ماندن ارگانیسم را تعیین می کنند، در حالی که لامین های نوع A عملکردهای تخصصی تری دارند. شواهدی مبنی بر دخالت لامین ها در رونویسی و پردازش پس از رونویسی RNA وجود دارد.
در دهه گذشته، جهش در LMNA با تعدادی از بیماری های بالینی متنوع همراه بوده است که در گروهی از لامینوپاتی ها دسته بندی می شوند. تشدید تحقیقات در این جهت منجر به افزایش قابل توجهی از انتشارات شد: تنها در سال 2005 تعداد آنها از 200 فراتر رفت. در لامینوپاتی ها، اختلالاتی مشاهده می شود که منجر به تغییر در ساختار ماهیچه های مخطط و چاقی، پلی نوروپاتی، لیپودیستروفی، کاردیومیوپاتی، کمک به ایجاد مقاومت به انسولین، اختلالات پوستی و غیره.
اما چشمگیرترین فنوتیپ ناشی از جهش در LMNA و اختلال پیرایش متعاقب آن، پروگریا یا سندرم پیری زودرس - سندرم هاچینسون-گیلفورد است. وجود لامین معیوب در هسته سلول منجر به تغییرات پاتولوژیک بسیاری می شود: محتوای تعدادی از پروتئین ها در هسته به شدت کاهش می یابد، پوشش هسته کوچک می شود و روند ترمیم خطاهایی که در طول سنتز DNA رخ می دهد مختل می شود. در نتیجه سلول ها توانایی تقسیم شدن خود را از دست می دهند، سلول های مرده با سلول های جدید جایگزین نمی شوند که منجر به پیری زودرس بدن می شود. این بیماران تا 20 سال عمر نمی کنند و در 10-12 سالگی شبیه افراد پیر کوچک باستانی به نظر می رسند.
یک رونق واقعی پیام پی. اسکافیدی و تی میستلی در مجله ساینس (2006) بود که نشان داد ژن LMNA مستقیماً نه تنها با ایجاد سندرم پروگریا، بلکه با روند "طبیعی" مرتبط است. تسریع نشده - پیری فیزیولوژیکی. دانشمندان دریافته اند که اتصال اشتباه RNA پیام رسان لامین نه تنها در بیماران مبتلا به پروگریا، بلکه در افراد سالم نیز اتفاق می افتد، اما با فرکانس بسیار کمتری. اگرچه مقدار لامین معیوب با افزایش سن افزایش نمی یابد، اما با گذشت زمان (در افراد مسن) تغییراتی در سلول ها مشابه تغییرات در بیماران مبتلا به پروگریا مشاهده می شود. در آزمایشی بر روی فیبروبلاستهای گرفته شده از افراد مسن، نشان داده شد که سرکوب پیوند نادرست منجر به جوانسازی سلولها میشود.
در یک مطالعه تجربی حیوانی که توسط گروهی از دانشمندان از ایالات متحده آمریکا و سوئد به رهبری L.G. فونگ نشان داده شد که برای عملکرد طبیعی پوسته های هسته و جلوگیری از پیری زودرس بدن، قبل از هر چیز وجود لامین C ضروری است.
در گزارش گروهی از دانشمندان دانشگاه ماساچوست (ژوئیه 2007)، یک واقعیت جالب ارائه شده است: جهش در ژن LMNB1 منجر به این واقعیت شد که محور هسته در سلول ها موقعیت خود را تغییر داد و در نتیجه، چرخش هسته ها مشاهده شد. این جهش ها بر تحرک اسکلت سلولی تأثیری نداشت. اگر محققان cDNA نوع وحشی را در سلولهای موش LMNB1 -/- بیان کنند، چرخش هستهها متوقف میشود. به گفته دانشمندان، لامین B1 ممکن است یک عملکرد لنگر داشته باشد، و ارتباطی بین پوشش هسته و اسکلت سلولی ایجاد کند. موش های معیوب در ژن LMNB1 در مراحل اولیه رشد مردند.
بنابراین، تا به امروز، داده های بسیار جالب و جالبی به دست آمده است که نشان دهنده اهمیت اساسی ژن هایی است که ساختار و عملکرد لامین ها را کنترل می کنند. با این حال، تأثیر لامین ها بر فعالیت حیاتی و عملکرد ارگانیسم به عنوان یک کل هنوز به خوبی درک نشده است و نیاز به مطالعه بیشتر دارد. شاید این منجر به کشف فرصت های جدید برای مبارزه با پیری و باز کردن راه های واقعی برای طول عمر فعال شود.
بازگشتهمچنین بخوانید:
05 ژوئن 2008فقط یک ژن - و یک دسته کامل از بیماری ها
منحصر به فرد بودن پروتئین XPD، که برای ترمیم آسیب DNA ضروری است، در این واقعیت نهفته است که جهش در بخش های مختلف ژن آن زمینه ساز سه بیماری است.
خوانده شده در 21 مه 2008ایالات متحده برنامه ملی بیماری های بی نام را راه اندازی کرد
مؤسسه ملی بهداشت ایالات متحده برنامه ای را برای کار با بیمارانی که بیماری هایشان آنقدر نادر است که هنوز حتی نامی ندارند آغاز می کند.
خوانده شده در 27 فوریه 2008جهش یافته ها را از بین ببرید
ارگانیسم یک حیوان بالاتر می تواند به طور بسیار موثری از شر میتوکندری های جهش یافته خلاص شود: آنها پس از 2-6 نسل ناپدید می شوند. انتخاب میتوکندری های طبیعی در سلول های زایای زن یا در سطح درون سلولی اتفاق می افتد.
خوانده شده در 08 فوریه 2008بیماری های ارثی: اکنون می توان شناسایی کرد، برای درمان - نه به زودی
تا همین اواخر، بیماریهای عمدتاً تک ژنی که با اختلال در یک ژن اتفاق میافتند، مورد مطالعه قرار گرفتهاند. اما بیشتر بیماری های ارثی با اختلال همزمان چندین ژن و تأثیر خاصی از محیط خارجی همراه است.
خوانده شده در 28 اوت 2007ژن های اسکیزوفرنی را در کوه ها جستجو می کنند
دانشمندان گروه سازگاری ژنتیکی انسان موسسه ژنتیک عمومی. N.I. موسسه واویلف آکادمی علوم روسیه چندین دهه است که با مطالعه نمایندگان مردم بومی داغستان در تلاش است تا ژن های مسئول بیماری های مزمن را شناسایی کند. در حال حاضر توجه محققان بر روی ژن هایی متمرکز شده است که وقوع اسکیزوفرنی را از پیش تعیین می کنند.
خوانده شده در 08 ژوئیه 2008از نتیجه گیری خسته کننده بپرهیزید
برنده جایزه نوبل که 80 ساله شد، تاکید کرد که هرگز علاقه خود را به علم از دست نداده است. در همان زمان، در کمال تعجب بسیاری، واتسون گفت که در تمام این سالها در زمانی که مسئولیت آزمایشگاه را برعهده داشت، عملاً با آن سروکار نداشت.
لایه هسته ای (صفحه هسته ای) - یک شبکه پروتئین فیبریلار سفت و سخت که توسط پروتئین های لامینین (رشته های میانی) تشکیل شده است، زیر غشای هسته ای قرار گرفته و از آن حمایت می کند. این یک لایه فیبری از غشای هسته ای با مجتمع های منفذی است. توسط لایه ای متشکل از رشته های میانی در هم تنیده (لامین ها) که اسکلت کاریوس را تشکیل می دهند، با پروتئین های انتگرال مرتبط است. رشتههایی از DNA کروموزومی به لایهی لامینا متصل میشوند، یعنی. در سازماندهی کروماتین نقش دارد. پروتئین های مجتمع های منافذ از نظر ساختاری با پروتئین های لایه هسته ای مرتبط هستند که در سازماندهی آنها نقش دارد. بنابراین، لایه نقش بسیار مهمی در حفظ شکل هسته، بسته بندی منظم کروماتین، سازماندهی ساختاری کمپلکس های منافذ و تشکیل کاریولما در حین تقسیم سلولی (تجزیه غشای هسته ای در پروفاز و ادغام در تلوفاز) ایفا می کند.
75. کروماتین. کروماتین - دانه ها و توده های کوچک است که در هسته سلول ها یافت می شود و رنگ (کروموس) را به خوبی درک می کند، از این رو نام آن است. از نظر شیمیایی، کروماتین از مجموعهای از DNA و پروتئین (شامل RNA نیز میباشد) و مربوط به کروموزومهایی است که با رشتههای نازک در هسته اینترفاز نشان داده میشوند و به عنوان ساختارهای جداگانه قابل تشخیص نیستند. کروماتین ماده کروموزوم است. کروماتین از فیبرهای کروماتین تشکیل شده است که می توانند به صورت شل یا فشرده در هسته قرار گیرند. بر این اساس، دو نوع کروماتین متمایز می شوند: یوکروماتین - کروماتین سست یا غلیظ شده (داسپرالیزه)، ضعیف با رنگ های اساسی رنگ آمیزی شده و در میکروسکوپ نوری قابل مشاهده نیست، برای رونویسی در دسترس است. هتروکروماتین - کروماتین فشرده یا متراکم (مارپیچ)، به خوبی با همان رنگ ها رنگ می شود و در زیر میکروسکوپ نوری قابل مشاهده است. در حین آماده سازی یک سلول برای تقسیم (اینترفاز)، فیبرهای کروماتین در هسته مارپیچی می شوند و کروماتین به کروموزوم تبدیل می شود. پس از تقسیم در هسته سلول های دختر، از بین رفتن اسپیرال فیبرهای کروماتین رخ می دهد و کروموزوم ها دوباره به کروماتین تبدیل می شوند. بنابراین کروماتین و کروموزوم ها فازهای مختلف یک ماده هستند. بنابراین، با توجه به ویژگی های مورفولوژیکی هسته (با نسبت محتوای یو- و هتروکروماتین)، می توان فعالیت فرآیندهای رونویسی (عملکرد سنتزی سلول) را ارزیابی کرد که با افزایش آن، این نسبت به نفع تغییر می کند. با سرکوب کامل عملکرد هسته (به عنوان مثال، در سلول های آسیب دیده و در حال مرگ، در طول کراتینه شدن اپیتلیوم) اندازه آن کاهش می یابد، فقط حاوی هتروکروماتین است و با رنگ های اساسی به شدت و به طور یکنواخت رنگ می شود. این پدیده کاریوپیکنوزیس نامیده می شود. توزیع هتروکروماتین و نسبت محتوای eu- و هتروکروماتین مشخصه سلول های هر نوع است که امکان شناسایی آنها را فراهم می کند. در همان زمان، نظم های کلی در توزیع هتروکروماتین در هسته وجود دارد: تجمعات آن در زیر کاریولما، در ناحیه منافذ (به دلیل ارتباط آن با لایه) و اطراف هسته قطع شده است. توده های کوچکتر در سراسر هسته پراکنده شده اند. بدن Bar مجموعه ای از هتروکروماتین است که مربوط به یک کروموزوم X در زنان است که در اینترفاز پیچ خورده و غیرفعال است. در بیشتر سلولها، در نزدیکی کاریولما قرار دارد، و در گرانولوسیتهای خون مانند یک بخش کوچک اضافی از هسته ("چوب درام") به نظر میرسد. تشخیص بدن نوار (معمولا در سلول های اپیتلیال مخاط دهان) به عنوان یک آزمایش تشخیصی برای تعیین جنسیت ژنتیکی استفاده می شود.
76. کروماتین منتشر و متراکم (eu- و heterochromatin).
کروماتین - دانه ها و توده های کوچک است که در هسته سلول ها یافت می شود و رنگ (کروموس) را به خوبی درک می کند، از این رو نام آن است. از نظر شیمیایی، کروماتین از مجموعهای از DNA، RNA و پروتئین تشکیل شده است که در آن DNA در درجات مختلفی از تراکم قرار دارد و مربوط به کروموزومهایی است که با رشتههای نازک در هسته اینترفاز نشان داده میشوند و به عنوان ساختارهای جداگانه قابل تشخیص نیستند. کروماتین ماده کروموزوم است. کروماتین از فیبرهای کروماتین تشکیل شده است که می توانند به صورت شل یا فشرده در هسته قرار گیرند. بر این اساس، دو نوع کروماتین متمایز می شوند: یوکروماتین - کروماتین سست یا غلیظ شده (داسپرالیزه)، ضعیف با رنگ های اساسی رنگ آمیزی شده و در میکروسکوپ نوری قابل مشاهده نیست، برای رونویسی در دسترس است. هتروکروماتین - کروماتین فشرده یا متراکم (مارپیچ)، به خوبی با همان رنگ ها رنگ می شود و در زیر میکروسکوپ نوری قابل مشاهده است. در حین آماده سازی یک سلول برای تقسیم (اینترفاز)، فیبرهای کروماتین در هسته مارپیچی می شوند و کروماتین به کروموزوم تبدیل می شود. پس از تقسیم در هسته سلول های دختر، از بین رفتن اسپیرال فیبرهای کروماتین رخ می دهد و کروموزوم ها دوباره به کروماتین تبدیل می شوند. بنابراین کروماتین و کروموزوم ها فازهای مختلف یک ماده هستند. بنابراین، با توجه به ویژگی های مورفولوژیکی هسته (با نسبت محتوای یو- و هتروکروماتین)، می توان فعالیت فرآیندهای رونویسی (عملکرد سنتزی سلول) را ارزیابی کرد که با افزایش آن، این نسبت به نفع تغییر می کند. با سرکوب کامل عملکرد هسته (به عنوان مثال، در سلول های آسیب دیده و در حال مرگ، در طول کراتینه شدن اپیتلیوم) اندازه آن کاهش می یابد، فقط حاوی هتروکروماتین است و با رنگ های اساسی به شدت و به طور یکنواخت رنگ می شود. این پدیده کاریوپیکنوزیس نامیده می شود. توزیع هتروکروماتین و نسبت محتوای eu- و هتروکروماتین مشخصه سلول های هر نوع است که امکان شناسایی آنها را فراهم می کند. در همان زمان، نظم های کلی در توزیع هتروکروماتین در هسته وجود دارد: تجمعات آن در زیر کاریولما قرار دارد، در ناحیه منافذ (به دلیل ارتباط آن با لایه) و اطراف هسته (دو هسته) قطع شده است. توده های کوچکتر در سراسر هسته پراکنده شده اند. بدن Bar مجموعه ای از هتروکروماتین است که مربوط به یک کروموزوم X در زنان است که در اینترفاز پیچ خورده و غیرفعال است. در بیشتر سلولها، در نزدیکی کاریولما قرار دارد، و در گرانولوسیتهای خون مانند یک بخش کوچک اضافی از هسته ("چوب درام") به نظر میرسد. تشخیص بدن نوار (معمولا در سلول های اپیتلیال مخاط دهان) به عنوان یک آزمایش تشخیصی برای تعیین جنسیت ژنتیکی استفاده می شود.