10.07.2017 شفق قطبی
در مطالب موجود در وب سایت خود، ما اغلب به مفهوم "ماتریس خارج سلولی" اشاره می کنیم، اما تاکنون به طور مفصل در مورد ترکیب و ساختار آن صحبت نکرده ایم. در این مقاله، ما به طور کامل این اصطلاح را رمزگشایی می کنیم و نشان می دهیم که چه موادی در ماتریکس وجود دارد، برای چه چیزی هستند و مهمتر از همه، چگونه می توان سلامت محیط بین سلولی را حفظ کرد.
بنابراین، در بدن انسان، سلول ها حدود 20٪ را تشکیل می دهند و 80٪ باقیمانده ماتریکس خارج سلولی است. ممکن است این احساس را داشته باشید که ماتریکس نوعی ماده است که سلول ها در آن شناور هستند. در واقع، هیچ چیز در هیچ کجا شناور نیست، همه چیز ساختاری کاملاً منظم دارد. ممکن است در بافت های مختلف متفاوت باشد، اما در بیشتر موارد تصویر تقریباً یکسان است.
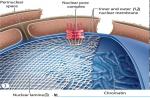
بیایید با یک نمایش شماتیک از غشای سلولی شروع کنیم. این یک لایه دو لایه از لیپیدها است که بیشتر آنها فسفولیپید هستند.
اینتگرین ها، دیستروگلیکان ها و گیرنده های دامنه دیسکویدین (DDRs) پروتئین هایی هستند که غشای سلولی را پوشش می دهند. اینها گیرنده های سلولی هستند که با محیط خارجی تعامل دارند و سیگنال های بین سلولی مختلفی را منتقل می کنند.

و سپس غشای پایه را دنبال می کند که سلول را از بافت همبند (ماتریکس) جدا می کند. یعنی سلول های اکثر بافت ها مستقیماً با ماتریکس تماس ندارند. غشای پایه توسط لامینین (صفحه روشن) و کلاژن نوع 4 (صفحه تیره) تشکیل می شود. آنها که توسط پروتئین نیدوژن (یا انتاکتین) محدود می شوند، ساختار فضایی را تشکیل می دهند و در درجه اول نقش حمایت مکانیکی و محافظت از سلول ها را ایفا می کنند. فیبرونکتین، یک گلیکوپروتئین که همچنین مسئول ساختار بافتی است، می تواند زنجیره های مولتیمری را تشکیل دهد. در چسبندگی، یعنی چسبندگی سلول ها شرکت می کند.
همچنین در اینجا مولکول های پروتئین پرلکان وجود دارد. این به حفظ سد اندوتلیال، سد فیزیولوژیکی بین سیستم گردش خون و سیستم عصبی مرکزی کمک می کند. این ماده از بافت عصبی در برابر میکروارگانیسم های در گردش در خون، سموم، عوامل سلولی و هومورال سیستم ایمنی که بافت عصبی را خارجی می دانند، محافظت می کند. پروتئوگلیکان آگرین نقش کلیدی را در اتصال عصبی عضلانی ایفا می کند که مسئول رساندن تکانه های عصبی به سلول های عضلانی است.
ما در جایی پیش می رویم که ماتریکس بین سلولی یا بافت همبند واقعی شروع می شود. با فیبرهای کلاژن نفوذ کرده است. این یک پروتئین فیبریلار است که اساس بافت همبند بدن (تاندون ها، استخوان ها، غضروف، درم و غیره) را تشکیل می دهد و استحکام و خاصیت ارتجاعی آن را تضمین می کند.
الاستین یک شبکه سه بعدی از الیاف پروتئینی را تشکیل می دهد. این شبکه نه تنها برای استحکام مکانیکی بافت مهم است، بلکه ارتباط بین سلولها را فراهم میکند، مسیرهای مهاجرت سلولها را تشکیل میدهد که در طول آن میتوانند حرکت کنند (به عنوان مثال، در طول رشد جنینی)، سلولها و بافتهای مختلف را از یکدیگر جدا میکند. به عنوان مثال، لغزش در مفاصل را فراهم می کند).
آگرکان (پروتئوگلیکان کندرویتین سولفات) - آب، اسید هیالورونیک و پروتئین ها را متصل می کند و اسمز ایجاد می کند، بنابراین بافت همبند، از جمله دیسک های بین مهره ای و سایر غضروف ها را با مقاومت در برابر بارهای سنگین می بخشد.
اسید هیالورونیک در بازسازی بافت نقش دارد. موجود در بسیاری از مایعات بیولوژیکی، از جمله سینوویال، مسئول ویسکوزیته بافت همبند است. در ارتباط با آگرکان، مقاومت در برابر فشار ایجاد می کند. همچنین هیالورونیک اسید جزء اصلی روان کننده بیولوژیکی و غضروف مفصلی است که در آن به صورت پوسته ای از هر سلول (کندروسیت) وجود دارد.
باید به کلاژن نوع 7 اشاره کرد که نقش یک عنصر ساختاری را ایفا می کند. به عنوان مثال، در پوست، این فیبریل های لنگر در رباط درم (خود پوست) و اپیدرم هستند.
البته، ترکیب ماتریکس همچنین شامل آب است - از 25٪ در بافت استخوان تا 90٪ در پلاسمای خون.
بنابراین، در نهایت چه چیزی در مقابل خود می بینیم؟ - ساختار منظمی که به نوعی در تمام بافت های انسان یافت می شود.

به عنوان مثال، در تصویر سمت چپ، یک اپیتلیوم طبقه بندی شده قرنیه چشم وجود دارد. از سلول های مسطح لایه بالایی، لایه میانی، سلول های دراز لایه پایه تشکیل شده است و سپس غشای پایه و بافت همبند می آید.
و در سمت راست اپیتلیوم نای است - و در اینجا ما به طور کلی همان چیز را می بینیم. فقط در لایه بالایی سلول های جام قرار دارند. به دنبال آن غشای پایه و ماتریس قرار می گیرد.
و چه نوع سلول هایی را در خود بافت همبند مشاهده می کنیم؟ در بیشتر بافت ها، اینها فیبروبلاست ها هستند - سلول هایی که کلاژن، الاستین و پروتئوگلیکان ها را تولید می کنند. همچنین، ممکن است سلول های چربی، سلول های پلاسما، در غضروف - کندروبلاست ها و کندروسیت ها و غیره وجود داشته باشد. بسته به نوع پارچه
لطفا توجه داشته باشید که ماتریس در هر دو حالت دارای ساختار قابل مشاهده است، اگرچه در تصاویر چندان واضح نیست. ساختار منظم ماتریکس بین سلولی نشانه جوانی و سلامتی است. اما با گذشت زمان، اثرات عوامل خارجی و داخلی منجر به تخریب تدریجی این ساختار می شود - بر این اساس، سلول ها از دریافت تغذیه کافی برای رشد و تقسیم طبیعی خود، هدایت عصبی، ارتباط بین سلول ها و تحرک آنها دست می کشند.
تماس های بین سلولی کمپلکس های پروتئینی تخصصی هستند که به دلیل آن سلول های همسایه با یکدیگر تماس می گیرند و با یکدیگر ارتباط برقرار می کنند.
ماتریکس خارج سلولی شبکه متراکمی از پروتئین ها است که بین سلول ها قرار گرفته و توسط سلول ها تشکیل می شود.
سلول ها گیرنده های پروتئین های ماتریکس خارج سلولی را بیان می کنند
پروتئین های ماتریکس خارج سلولی و اتصالات بین سلولی سازماندهی سه بعدی سلول ها در بافت ها و همچنین رشد، تحرک، شکل و تمایز آنها را کنترل می کنند.
یکی از مهمترین وقایع در تکامل موجودات زنده ظاهر بود موجودات چند سلولی. هنگامی که سلول ها راهی برای گروه بندی ایجاد کردند، توانایی تشکیل جوامعی را به دست آوردند که در آن سلول های مختلف در عملکرد تخصص داشتند. به عنوان مثال، اگر دو موجود تک سلولی "نیروها" را به هم بپیوندند، می توان تصور کرد که هر یک از آنها در انجام وظایف خاصی که برای رشد و تولید مثل موفقیت آمیز ضروری هستند، تخصص دارند و بقیه را به شریک خود واگذار می کنند.
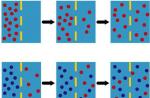
برای تحصیلات ارگانیسم چند سلولی سادهیا بافت های موجودات پیچیده تر، سلول ها باید به طور ایمن به یکدیگر متصل شوند. همانطور که در شکل زیر نشان داده شده است، برای سلول های جانوری، این چسبندگی به سه روش قابل دستیابی است. ابتدا، سلول ها مستقیماً از طریق تشکیل تماس های بین سلولی به یکدیگر متصل می شوند، که تغییرات خاصی در سطح سلولی سلول های همسایه است. این تماس ها در میکروسکوپ الکترونی قابل مشاهده هستند. دوم، سلولها میتوانند با استفاده از پروتئینهایی که چنین مناطق تخصصی را تشکیل نمیدهند، بدون ایجاد تماس با یکدیگر ارتباط برقرار کنند. ثالثاً، سلولها با اتصال به شبکهای از ماتریکس خارج سلولی (ECM)، که حاوی مولکولهای واقع در محیط بین سلولی است، بهطور غیرمستقیم به هم متصل میشوند.
پیوست سلولیبه دلیل ایجاد تماس های سطح آنها با ماتریکس خارج سلولی رخ می دهد.
با این حال، تشکیل ارگانیسم چند سلولیکار ساده ای نیست که چندین سلول را به یکدیگر بچسبانید. عملکرد صحیح چنین جوامع سلولی با تعامل مؤثر و تقسیم کار بین آنها تضمین می شود. تماس های بین سلولی نواحی بسیار تخصصی هستند که در آن سلول ها از طریق کمپلکس های پروتئینی مرتبط با غشاها به یکدیگر متصل می شوند. چندین نوع مختلف از تماس های بین سلولی شناخته شده است که هر یک نقش خاصی در ارتباط سلول ها بین خود دارند.
سنجاب ها، تشکیل اتصالات شکافسلولها را قادر میسازد تا مستقیماً با یکدیگر ارتباط برقرار کنند و کانالهایی را تشکیل دهند که از طریق آن تبادل مولکولهای کوچک سیتوپلاسمی انجام میشود. پروتئین هایی که اتصالات محکم ایجاد می کنند به عنوان یک مانع انتخابی عمل می کنند که عبور مولکول ها را از لایه سلولی تنظیم می کند و از انتشار پروتئین ها در غشای پلاسما جلوگیری می کند. اتصالات چسبنده و دسموزوم ها با پیوند دادن اسکلت سلولی سلول های در تماس، پایداری مکانیکی ایجاد می کنند، در نتیجه لایه سلولی می تواند به عنوان یک کل واحد عمل کند. این تماس ها می توانند به عنوان فرستنده سیگنال عمل کنند و تغییرات سطح سلول را به سیگنال های بیوشیمیایی تبدیل کنند که در سراسر سلول منتشر می شوند.
طرح های ساختار تماس های بین سلولی سلول های اپیتلیال (سمت چپ)،مجتمعهای چسب تماسی سلولهای با منشا غیر اپیتلیالی (راست) و مجتمعهای سلولی با ماتریکس خارج سلولی (در زیر).
کلاس های اصلی اجزا (PCM) نیز نشان داده شده است.
انواع مختلفی از پروتئین ها نیز در این امر دخیل هستند در تعامل بدون تماس سلول ها. این پروتئین ها شامل اینتگرین ها، کادرین ها، سلکتین ها و مولکول های مرتبط با ایمونوگلوبولین هستند که باعث افزایش چسبندگی سلولی می شوند.
همه سلول ها، حتی بیشتر موجودات تک سلولی اولیه، کارکردهای شناخت محیط خارجی و تعامل با آن را دارند. حتی قبل از ظهور جوامع سلولی، سلول ها باید خود را به سطوح متصل می کردند و در آنها حرکت می کردند. بنابراین، ساختارهای چسبنده ماتریکس سلولی در اوایل تکامل شکل گرفتند. همانطور که در شکل زیر نشان داده شده است، در موجودات چند سلولی، فضای بین سلول ها با ساختار متراکمی از پروتئین ها و قندها به نام ماتریکس خارج سلولی پر شده است. ماتریکس خارج سلولی به شکل الیاف، لایه ها و ساختارهای فیلم سازماندهی شده است.
در برخی بافت ها ماتریکس خارج سلولیبه صورت لایه های پیچیده ای است که لایه بازال نامیده می شود و مستقیماً با سلول ها در تماس است. پروتئین های تشکیل دهنده ماتریکس خارج سلولی دو نوع هستند: گلیکوپروتئین های ساختاری مانند کلاژن و الاستین و پروتئوگلیکان ها. این پروتئین ها به بافت ها استحکام و خاصیت ارتجاعی می دهند و همچنین به عنوان یک فیلتر انتخابی عمل می کنند که جریان اجزای نامحلول را بین سلول ها کنترل می کند. پروتئوگلیکان ها خواص آبدوستی از خود نشان می دهند و محیط آبی را بین سلول ها حفظ می کنند. هنگامی که سلول ها مهاجرت می کنند، ماتریکس خارج سلولی به عنوان یک ساختار پشتیبانی برای حرکت آنها عمل می کند.
سلول ها ترشح می کنند اجزای ماتریکس خارج سلولی. آنها خود این سیستم پشتیبانی خارجی را تشکیل می دهند و در صورت لزوم می توانند شکل آن را به دلیل تخریب و جایگزینی مناطق اطراف ماتریس تغییر دهند. در حال حاضر، مسائل مربوط به کنترل مونتاژ و تخریب ماتریکس خارج سلولی از اهمیت قابل توجهی برخوردار است، زیرا آنها نقش مهمی در توسعه ارگانیسم های چند سلولی، در بهبود زخم و همچنین در تشکیل تومورهای بدخیم دارند.
تماس سلول ها با ماتریکس خارج سلولیتوسط پروتئینهای گیرنده سطح سلولی تشکیل میشوند، که وقتی جمع میشوند، ساختارهای جزیرهای (پچ) روی سطح سلول ایجاد میکنند و ماتریکس خارج سلولی واقع در خارج غشای پلاسما را با اسکلت سلولی از سیتوزول متصل میکنند. مانند برخی از تماس های بین سلولی، برخی از این پروتئین ها مجتمع های منظمی را تشکیل می دهند که سطح سلول را به اسکلت سلولی متصل می کند. این پروتئین ها عملکرد بسیار گسترده تری نسبت به "مکنده سلولی" دارند. آنها همچنین در بسیاری از فرآیندهای سیگنال دهی دخالت دارند و به سلول ها اجازه می دهند با یکدیگر ارتباط برقرار کنند.
مختلف سلول هاآنها همراه با ماتریکس خارج سلولی خود، بافت هایی را تشکیل می دهند که با درجه بالایی از تخصص مشخص می شوند. غضروف، استخوان و سایر انواع بافت همبند می توانند استرس مکانیکی قوی را تحمل کنند، در حالی که بقیه، مانند بافتی که ریه ها را تشکیل می دهد، قوی نیستند، اما بسیار الاستیک هستند. تعادل بین استحکام، کشش و ساختار سه بعدی به دقت کنترل می شود و اجزای هر پارچه عملکرد خود را در تعامل با یکدیگر انجام می دهند. بنابراین، سازماندهی و ترکیب بافت با عملکرد انجام شده توسط اندام مطابقت دارد. مثلا ماهیچه ها کاملا با پوست فرق دارند و خدا را شکر!
تماس های بین سلولیو اتصال سلول ها به ماتریکس به سطح سلول محدود نمی شود. در بسیاری از موارد، پروتئین ها باید به اندازه کافی در غشاء لنگر انداخته شوند تا در برابر نیروهای مکانیکی مقاومت کنند. این امر مستلزم اتصال آنها به اسکلت سلولی است که اساساً پشتیبانی ساختاری برای سلول فراهم می کند. وجود اسکلت سلولی همچنین از جابجایی جانبی گیرنده ها در صفحه غشاء جلوگیری می کند و آنها را در جای خود نگه می دارد. همراه با این، فرآیندهای انتقال سیگنال، مونتاژ تماس های بین سلولی را تنظیم می کند و آنها را حفظ می کند. اسکلت سلولی و مکانیسم های سیگنالینگ نقش اساسی در چسبندگی سلول ایفا می کنند.
ماتریکس خارج سلولی اساس بافت همبند را تشکیل می دهد، پشتیبانی مکانیکی از سلول ها و انتقال مواد شیمیایی را فراهم می کند. علاوه بر این، سلولهای بافت همبند با مواد ماتریکس (همیدزموزومها، تماسهای چسبنده و غیره) تماسهای بین سلولی ایجاد میکنند که میتوانند عملکردهای سیگنالینگ را انجام دهند و در حرکت سلولی شرکت کنند. بنابراین، در طول جنین زایی، بسیاری از سلول های حیوانی مهاجرت می کنند، در امتداد ماتریکس خارج سلولی حرکت می کنند و اجزای منفرد آن نقش نشانگرهایی را ایفا می کنند که مسیر مهاجرت را تعیین می کنند.
اجزای اصلی ماتریکس خارج سلولی گلیکوپروتئین ها، پروتئوگلیکان ها و اسید هیالورونیک هستند. کلاژن گلیکوپروتئین غالب ماتریکس خارج سلولی در اکثر حیوانات است. ترکیب ماتریکس خارج سلولی شامل بسیاری از اجزای دیگر است: پروتئین های فیبرین، الاستین، و همچنین فیبرونکتین ها، لامینین ها و نیدوژن ها. ترکیب ماتریکس خارج سلولی بافت استخوانی شامل مواد معدنی مانند هیدروکسی آپاتیت است. را می توان یک ماتریکس خارج سلولی و اجزای بافت همبند مایع - پلاسمای خون و مایع لنفاوی در نظر گرفت.
یادداشت
بنیاد ویکی مدیا 2010 .
ببینید «ماتریس خارج سلولی» در فرهنگهای دیگر چیست:
Matrix - همه کدهای تبلیغاتی تخفیف فعلی Matrix در دسته لوازم آرایش مو و لوازم آرایشی مو
اصطلاح ماتریکس، خارج سلولی واژه انگلیسی matrix extracellular مترادف اختصارات اصطلاحات مرتبط نانو اشیاء زیستی، پوششهای زیست سازگار، سلول، پروتئوم، پروتئومیکس تعریف در زیستشناسی، ساختارهای بافت خارج سلولی.…… فرهنگ لغت دایره المعارف نانوتکنولوژی
ماتریکس خارج سلولی (به انگلیسی ماتریکس خارج سلولی، ECM) در زیست شناسی ساختارهای بافت غیر سلولی نامیده می شود. ماتریکس خارج سلولی اساس بافت همبند است و توسط سلول های آن تشکیل می شود. پشتیبانی مکانیکی برای بافت ها فراهم می کند. پایه ... ... ویکی پدیا
این بافتی از یک موجود زنده است که مستقیماً مسئول عملکرد هیچ اندام یا سیستم اندامی نیست، اما نقش حمایتی را در همه اندام ها ایفا می کند و 60 تا 90 درصد از جرم آنها را تشکیل می دهد. عملکردهای حمایتی، حفاظتی و تغذیه ای را انجام می دهد. ... ... ویکی پدیا
بیوفیلم مجموعه ای (کنگلومرا) از میکروارگانیسم های واقع بر روی سطحی است که سلول های آن به یکدیگر متصل هستند. معمولا سلول ها در ماده پلیمری خارج سلولی (ماتریکس خارج سلولی) ترشح شده توسط آنها غوطه ور می شوند ... ... ویکی پدیا
بافت همبند بافتی از یک موجود زنده است که به عملکرد خود هیچ اندامی مربوط نمی شود، اما در نقش های کمکی در همه آنها وجود دارد و 60 تا 90 درصد جرم آنها را تشکیل می دهد. عملکردهای حمایتی، حفاظتی و تغذیه ای را انجام می دهد. ... ... ویکی پدیا
ماتریکس بین سلولی - مجموعه ای از اجزای آلی و معدنی که فضای بین سلول ها را پر می کند. بافت های مختلف ماتریکس بین سلولی خاص خود را دارند. سلول های اپیتلیال عمدتاً توسط گلیکوپروتئین ها، پروتئین های متصل به کلسیم، متصل می شوند. ساختار ویژه ماتریکس بین سلولی در بافت هایی با منشاء مزانشیمی ذاتی است که عملکردهای مکانیکی، محافظتی و تغذیه ای را انجام می دهند. آنها تقسیم می شوند:
بافت همبند مناسب - شل، شکل نگرفته،
متراکم تزئین شده و شکل نگرفته؛ بافت هایی با خواص ویژه - چربی، رنگدانه،
مشبک و مخاطی؛ بافت های اسکلتی - استخوان و غضروف.
همه این انواع بافت همبند به طور گسترده در سرتاسر بدن و به ویژه در سر و گردن وجود دارند.
1.1. سازماندهی ماتریس بین سلولی
بافت همبند با وجود مقدار زیادی ماده بین سلولی (ماتریکس خارج سلولی)، متشکل از پروتئین های کلاژن، پروتئوگلیکان ها و گلیکوپروتئین ها و تعداد کمی سلول در فاصله قابل توجهی از یکدیگر مشخص می شود. فیبروبلاست ها، کندروبلاست ها، استئوبلاست ها، ادونتوبلاست ها، سمنوبلاست ها و سایر سلول های بلاست در تشکیل ماده بین سلولی شرکت می کنند. یکی از ویژگی های بافت های معدنی وجود یون های معدنی در ماده بین سلولی است که نمک ها و کریستال ها را تشکیل می دهند.
ماتریکس خارج سلولی حاوی مولکول هایی است که قادر به خودآرایی برای تشکیل کمپلکس هستند. با توجه به مکان مشخصی از مراکز اتصال روی مولکول ها و ویژگی برهمکنش آنها، یک ساختار سه بعدی بسیار منظم از ماتریکس خارج سلولی تشکیل می شود که ویژگی های عملکردی آن را تعیین می کند (شکل 1.1).
برنج. 1.1.سازماندهی ساختاری ماتریکس بین سلولی و رابطه آن با
سلول ها:
آ -پوسته ی مقر اصلی؛ ب -سازمان فوق مولکولی ماتریس در
بافت همبند [با توجه به Campbell N. A.، Reece J. B.، 2002، با تغییرات].
شکل تخصصی ماتریکس خارج سلولی بافت طبیعی غشای پایه است که ساختار مجزایی را تشکیل می دهد که یک لایه سلولی را از لایه دیگر جدا می کند. این نه تنها مسئول تمایز ساختارهای مختلف و حفظ معماری بافت است، بلکه بر تمایز، مهاجرت و فنوتیپ سلولی آنها نیز تأثیر می گذارد. غشای پایه به عنوان مانعی برای ماکرومولکول ها عمل می کند.
اجزای اصلی ماتریکس خارج سلولی انواع مختلفی از پروتئین های کلاژن و غیر کلاژن هستند.
1.2. ساختار و خواص پروتئین های کلاژن
اساس ماتریکس خارج سلولی خانواده پروتئین های کلاژن است که مربوط به گلیکوپروتئین ها و حاوی تعداد زیادی باقی مانده است. گلیسین، پرولینو هیدروکسی پرولین. کلاژن ها توسط 20 پروتئین نشان داده می شوند که برخی از آنها در واقع هستند
کلاژن ها، در حالی که بقیه فقط شامل حوزه های کلاژن مانند هستند. همه انواع کلاژن ها، بسته به ساختار، به چند گروه تقسیم می شوند: فیبریل ساز، همراه با فیبریل های کلاژن، رتیکولار، میکروفیبریل ها، فیبریل های مهار شده و غیره. برای تعیین هر نوع کلاژن از فرمول خاصی استفاده می شود که در آن یک -زنجیره ها با اعداد عربی و نوع کلاژن رومی نوشته می شود.
بخش عمده ای از کلاژن های موجود در بافت های حفره دهان فیبریل ساز هستند. محلی سازی انواع اصلی پروتئین های کلاژن در بافت های حفره دهان در جدول ارائه شده است. 1.1.
جدول 1.1
انواع پروتئین های کلاژن در بافت های دهان
بافت های حفره دهان با حضور انواع کلاژن I، III، V و VI مشخص می شوند. باید به تنوع کلاژن در سیمان دندان اشاره کرد که در آن علاوه بر کلاژن های نوع I، III و V، کلاژن های نوع II، IX، XII، XIV مشخصه بافت غضروف مشخص می شود.
کلاژن های فیبریل ساز
همه کلاژن های فیبریل ساز از نظر ترکیب اسید آمینه و محتوای کربوهیدرات متفاوت هستند.
مولکول های کلاژن نوع I، II، III، V، XI به شکل فیبریل هستند و از واحدهای ساختاری به نام تروپوکلاژن ساخته می شوند. مولکول های تروپوکلاژن (M r 300 kDa) ضخامت 1.5 نانومتر و 300 نانومتر طول دارند. آنها توسط سه زنجیره پلی پپتیدی تشکیل می شوند که به آنها زنجیره های a گفته می شود. هر زنجیره حاوی حدود 1000 باقیمانده اسید آمینه است و یک مارپیچ محکم سمت چپ است که حاوی سه باقی مانده اسید آمینه در هر نوبت است. یک سوم از باقی مانده اسیدهای آمینه در کلاژن گلیسین است.
(30%)، یک پنجم پرولین در کل با 3- و 4-هیدروکسی پرولین (21%)، بنابراین ساختار اولیه کلاژن را می توان به عنوان طرحی از gly - x - y - نشان داد، جایی که x اغلب پرولین یا پرولین است. هیدروکسی پرولین و y - سایر اسیدهای آمینه (شکل 1.2). در مجموع، حدود 330 تکرار از این قبیل در زنجیره a یافت می شود.

برنج. 1.2.قطعه ای از ساختار اولیه a - زنجیره های کلاژن در ناحیه ای که پرولین و هیدروکسی پرولین قرار دارند، "شکستن پرولین" رخ می دهد.
گلیسین توالی تکرار شونده gly - x - y - برای تشکیل ساختار فیبریلار ضروری است، زیرا رادیکال هر اسید آمینه دیگری بین سه زنجیره پپتیدی در مرکز مارپیچ سه گانه قرار نمی گیرد. پرولین و هیدروکسی پرولین چرخش زنجیره پلی پپتیدی را محدود می کنند. رادیکال های اسید آمینه که در موقعیت های -x- و -y- قرار دارند در سطح مارپیچ سه گانه قرار دارند. توزیع خوشه های رادیکال در طول مولکول کلاژن، خودآرایی ساختارهای کلاژن چند مولکولی را فراهم می کند. سه زنجیر a ساختاری را تشکیل می دهند که کمی به صورت مارپیچ پیچ خورده اند. با تشکیل فیبریل ها، مولکول های تروپوکلاژن (تریمرها) به صورت پلکانی مرتب می شوند و نسبت به یکدیگر به اندازه یک چهارم طول جابجا می شوند که به فیبریل ها یک خط خطی مشخص می دهد. فیبریل های کلاژن تشکیل شده با رسوب در بافت ها از طریق تشکیل پیوندهای متقاطع کووالانسی تثبیت می شوند (شکل 1.3).
کلاژن نوع I 2 آ 2 حاوی 33٪ گلیسین، 13٪ پرولین، 1٪ هیدروکسی لیزین و مقدار کمی کربوهیدرات است. در ترکیب استخوان ها، عاج، پالپ دندان، سیمان، فیبرهای پریودنتال تعیین می شود. این نوع الیاف کلاژن در فرآیندهای کانی سازی نقش دارند.
کلاژن نوع دوم[α 1 (II)] 3 در غضروف وجود دارد و در بافت های غیر غضروفی در اوایل رشد تشکیل می شود. این نوع کلاژن حاوی مقدار کمی 5-هیدروکسی لیزین (کمتر از 1٪) است و با محتوای بالای کربوهیدرات (بیش از 10٪) مشخص می شود.
کلاژن نوع III[α 1 (III)] 3 در دیواره رگ های خونی وجود دارد. ویژگی بارز این کلاژن وجود مقدار زیادی هیدروکسی پرولین است. زنجیره های α حاوی سیستئین هستند و خود مولکول کلاژن گلیکوزیله ضعیفی دارد.
کلاژن نوع V [α(V)α 2 (V)α 3 (V)] یک مولکول هیبریدی متشکل از زنجیره های مختلف است، یعنی: α1 (V)، α2 (V) و α3 (V).
کلاژن های فیبریلار همچنین می توانند حاوی 2 یا چند نوع مختلف کلاژن باشند. بنابراین، در برخی بافت ها مولکول های هیبریدی حاوی زنجیره های کلاژن نوع V و XI وجود دارد.

برنج. 1.3.ساختار فیبرهای کلاژن: آ -تروپوکلاژن، متشکل از سه α - زنجیر ; ب -میکروفیبریل های کلاژن از 5 ردیف تروپوکلاژن؛ V -فیبریل های کلاژن حاوی 9-12 میکروفیبریل تروپوکلاژن.
کلاژن های مرتبط با فیبریل
انواع کلاژن IX، XII، XIV در سازماندهی ماتریکس بین سلولی غشای مخاطی، غضروف و سیمان ریشه دندان نقش دارند. پروتئین های کلاژن این دسته قادر به تشکیل فیبریل نیستند، اما با اتصال به کلاژن های فیبریلار، طول، ضخامت و جهت فیبرهای کلاژن نوع I و II را محدود می کنند. یک ویژگی خاص کلاژن های مرتبط با فیبریل ها وجود هر دو حوزه کروی و فیبریلار در ساختار آنها است.
زنجیره های α از کلاژن نوع IX [α(IX)α 2 ( IX )α 3 (IX)]از 3 حوزه فیبریلار و 4 حوزه کروی تشکیل شده است. آنها توسط پیوندهای کووالانسی عرضی با فیبرهای کلاژن نوع II به هم متصل می شوند. مولکول کلاژن نوع IX همچنین حاوی یک زنجیره جانبی گلیکوزآمینوگلیکان و تعداد زیادی گروه با بار مثبت است، بنابراین مولکول های دارای بار منفی هیالورونیک اسید و کندرویتین سولفات می توانند به آن بپیوندند. کلاژنهای نوع XII با کلاژنهای فیبریل نوع I وارد برهمکنشهای مشابهی میشوند. این نوع کلاژن در غضروف، سیمان و همچنین در مخاط دهان در محل اتصال اپیتلیوم به لایه های زیر اپیتلیال قرار دارد. کلاژن نوع IX یک پروتئین غشایی است که لامینا دنسا(صفحه تیره غشای پایه، واقع در مرز با درم پاپیلاری) به فیبرهای کلاژن درم پاپیلاری ثابت می شود.
انواع غیر فیبریلار (شبکه ای) کلاژن
گروه کلاژن های غیر فیبریلار شامل پروتئین های کلاژن IV، VIII و X است که از نظر طول و اندازه متفاوت هستند و قادر به تشکیل ساختارهای شبکه ای هستند. شایع ترین، از جمله در بافت های حفره دهان، کلاژن نوع IV، که پروتئین ساختاری اصلی غشاهای پایه است. کلاژن نوع IV شامل 1 زنجیره α 1 (IV) و 2 α 2 (IV) است. زنجیره های پپتیدی کلاژن نوع IV پس از ترشح دچار تغییر پروتئولیتیک نمی شوند و بنابراین ساختار حوزه های کروی ترمینال N و C (NC 1، 7S و NC 2) را حفظ می کنند (شکل 1.4).
برنج. 1.4.ساختار کلاژن نوع IV یک مارپیچ سه گانه از مونومر کلاژن است. نواحی ترمینال N و C شامل حوزه های کروی 7S، NC 1 و NC 2 هستند.
برخلاف کلاژنهای فیبریلار، زنجیرههای α مولکولهای کلاژن نوع IV حاوی نواحی اسید آمینه غیرکلاژنی هستند نه تنها در بخشهای N و C ترمینال، بلکه در کل مولکول. دامنههای انتهایی NC 1، 7S مونومرهای کلاژن در فرآیند خود تجمعی با یکدیگر تعامل دارند و پیوندهای سرتاسری را تشکیل میدهند که منجر به تشکیل دایمرها و تریمرها میشود. ابرکویل توسط فعل و انفعالات جانبی و اتصالات انتها به انتها ایجاد می شود. در نتیجه، ساختارهای سه بعدی شبیه به شبکه ای با سلول های شش ضلعی به اندازه 170 نانومتر تشکیل می شود.
کلاژن نوع X از 3 زنجیره یکسان با یک پایه تشکیل شده است. با وزن 59 کیلو دالتون
میکروفیبریل های تشکیل دهنده کلاژن
کلاژن نوع VI به عنوان کلاژن تشکیل دهنده میکروفیبریل شناخته می شود. به عنوان یک پروتئین با زنجیره کوتاه، میکروفیبریل هایی را تشکیل می دهد که بین فیبریل های کلاژن های بینابینی قرار دارند. این نوع کلاژن با حضور دامنه های کروی بزرگ در زنجیره های α در نواحی ترمینال N و C و یک دامنه کوتاه سه مارپیچ بین آنها مشخص می شود. در فرآیند سنتز در داخل سلول، 2 مولکول از این کلاژن به صورت ضد موازی ترکیب شده و دایمر را تشکیل میدهند و از دایمرهایی که از سلول ترشح میشوند، تترامرها تشکیل میشوند. در خارج از سلول، تترامرها از سر به انتها متصل می شوند و میکروفیبریل ها را تشکیل می دهند. مولکول های این کلاژن دارای توالی های متعددی هستند arg-gli-asp(RGD)، که با اتصال به پروتئین های چسب غشایی - اینتگرین α 1 β 1 ، چسبندگی سلول را فراهم می کند. و α 2 β 1 . علاوه بر این، کلاژن نوع VI قادر است به فیبرهای کلاژن بینابینی، پروتئوگلیکان ها و گلیکوزآمینوگلیکان ها متصل شود.
سنتز کلاژن
کلاژن تقریباً توسط تمام سلول ها (فیبروبلاست ها، کندروبلاست ها، استئوبلاست ها، ادونتوبلاست ها، سمنتوبلاست ها، کراتوبلاست ها و غیره) سنتز و به ماتریکس خارج سلولی عرضه می شود. سنتز و بلوغ کلاژن یک فرآیند پیچیده چند مرحله ای است که از سلول شروع می شود و به ماتریکس خارج سلولی ختم می شود. اختلالات در سنتز کلاژن ناشی از جهش در ژن ها، و همچنین در طول ترجمه و اصلاح پس از ترجمه، با ظاهر کلاژن های معیوب همراه است. از آنجایی که حدود 50 درصد از کل پروتئین های کلاژن در بافت های اسکلتی و 40 درصد باقی مانده در درم و 10 درصد در استرومای اندام های داخلی یافت می شود، اختلالات سنتز کلاژن با آسیب شناسی هایی مانند
سیستم اسکلتی عضلانی و اندام های داخلی. این به طور اجتناب ناپذیری بر وضعیت بافت های ناحیه فک و صورت تأثیر می گذارد.
سنتز کلاژن شامل دو مرحله است. در مرحله داخل سلولیترجمه و اصلاح پس از ترجمه زنجیره های پلی پپتیدی رخ می دهد، و در ادامه خارج سلولی -اصلاح پروتئین، که با تشکیل فیبرهای کلاژن به اوج خود می رسد (شکل 1.5).
برنج. 1.5.سنتز کلاژن. طرح سنتز کلاژن: آ -مرحله داخل سلولی ب -اصلاح پروتئین خارج سلولی اعداد نشان دهنده واکنش های سنتز هستند. 1a -رونویسی، 1b-ترجمه زنجیره پروکلاژن، 2 - برش پپتید سیگنال، 3 - هیدروکسیلاسیون باقی مانده های پرولین و لیزین، 4 - گلیکوزیلاسیون 5-هیدروکسی لیزین و آسپاراژین، 5 - تشکیل پیوندهای دی سولفیدی در پپتیدهای ترمینال N و C، 6 - تشکیل مارپیچ سه گانه پروکلاژن، 7 - اگزوسیتوز یک مولکول پروتئین، 8 - برش پپتیدهای N و ترمینال، 9 - مجموعه فیبریل قابل تنظیم، 10 - اکسیداسیون لیزین و 5-هیدروکسی لیزین به آلیزین، 11 - تشکیل پیوندهای متقابل با تشکیل پپتیدهای پلیمری [طبق نظر Kolman Ya.، Rem K.-G.، 2000، با تغییرات]. آنزیم ها:
1 - پروکلاژن پرولین-4-دیاکسیژناز؛
2 - procollagenlysin-5-dioxygenase;
3 - پروتئین-لیزین-6-اکسیداز.
مرحله درون سلولی سنتز کلاژن . پپتید آلفا زنجیره های کلاژن بر روی پلی ریبوزوم های مرتبط با غشای شبکه آندوپلاسمی سنتز می شوند. زنجیره های پپتیدی سنتز شده آن در مخازن تحت تغییرات پس از ترجمه قرار می گیرند که شامل:
حذف پپتید سیگنال زنجیره پروکلاژن با مشارکت یک پروتئیناز خاص.
هیدروکسیلاسیون باقیمانده های پرولین و لیزین، که در طول انتقال زنجیره پلی پپتیدی تا جدا شدن آن از ریبوزوم ها آغاز می شود.
واکنش های هیدروکسیلاسیون توسط اکسیژنازها کاتالیز می شود: پروکلاژنپرولیل-4-دیاکسیژناز (پرولیل-4-هیدروکسیلاز)، پروکلاژنپرولیل-3-دیاکسیژناز (پرولیل-3-هیدروکسیلاز) و پروکلاژن لیزیل-5-دیاکسیژناز (لیزیل-5-). O 2 و 2-oxoglutarate در واکنش هیدروکسیلاسیون استفاده می شود و اسید اسکوربیک به عنوان یک کوفاکتور نقش دارد. پرولین و لیزین هیدروکسیلازها حاوی Fe 2+ در مرکز فعال هستند و اسید آسکوربیک که به راحتی به اسید دهیدروآسکوربیک اکسید می شود، برای حفظ اتم آهن در فروفرم ضروری است (شکل 1.6).

برنج. 1.6.فرمول ساختاری اسید اسکوربیک
در واکنش های هیدروکسیلاسیون، یک اتم اکسیژن به اتم چهارم کربن در باقیمانده پرولین متصل می شود و اتم اکسیژن دوم در اسید سوکسینیک قرار می گیرد که در طی دکربوکسیلاسیون 2-oxoglutarate تشکیل می شود (شکل 1.7).
همراه با هیدروکسیلاسیون پرولین، هیدروکسیلاسیون باقی مانده های لیزین با تشکیل 5-هیدروکسی لیزین اتفاق می افتد (شکل 1.8).
متعاقباً، بقایای لیزین هیدروکسیله شده تحت گلیکوزیلاسیون قرار می گیرند.
با مشارکت گلیکوزیل ترانسفرازها، پیوندهای کووالانسی O-گلیکوزیدی بین گروه 5-OH هیدروکسی لیزین و باقیمانده گالاکتوز یا دی ساکارید گالاکتوزیل گلوکز تشکیل می شود. مولکول های N-استیل گلوکزامین یا مانوز به گروه آمید آسپاراژین متصل می شوند. همزمان با هیدروکسیلاسیون پرولین، یک ساختار سه مارپیچ پایدار از کلاژن تشکیل می شود (شکل 1.9).

برنج. 1.7.هیدروکسیلاسیون باقی مانده های پرولین در زنجیره α پروکلاژن با تشکیل 4-هیدروکسی پرولین.

برنج. 1.8.هیدروکسیلاسیون بقایای لیزین در زنجیره پرو کلاژن با تشکیل 5 هیدروکسی لیزین.
هیدروکسی پرولین برای تثبیت این مارپیچ سه گانه کلاژن ضروری است، زیرا گروه های هیدروکسیل آن در تشکیل پیوندهای هیدروژنی بین زنجیره های α نقش دارند. پس از اتمام هیدروکسیلاسیون و گلیکوزیلاسیون، تمام زنجیره های pro-α توسط پیوندهای هیدروژنی به هم متصل می شوند و پل های دی سولفیدی در ناحیه پروپپتیدهای ترمینال C تشکیل می شوند.

برنج. 1.9.مناطق گلیکوزیله از زنجیره α مولکول پروکلاژن.
از شبکه آندوپلاسمی، مولکول های پروکلاژن به سمت دستگاه گلژی حرکت می کنند، جایی که در وزیکول های ترشحی قرار می گیرند و در ترکیب خود به فضای خارج سلولی ترشح می شوند.
مرحله خارج سلولی - اصلاح مولکول های پروکلاژن . در فضای بین سلولی، با مشارکت آنزیم های پروتئولیتیک، پپتیدهای N و C ترمینال از مولکول پروکلاژن جدا شده و مارپیچ سه گانه کلاژن (تروپوکلاژن) آزاد می شود. در مرحله بعد، فرآیند خودآرایی فیبرهای کلاژن، که توسط پیوندهای کووالانسی بین مولکولی (پیوندهای متقاطع) ثابت شده است، رخ می دهد. تشکیل این پیوندها شامل بقایای لیزین و 5-هیدروکسی لیزین و مشتقات آلدئیدی آنها است که در نتیجه دآمیناسیون اکسیداتیو تشکیل می شوند. دآمیناسیون اکسیداتیو لیزین و 5-هیدروکسی لیزین با مشارکت لیزیل اکسیداز رخ می دهد. از ویژگی های این آنزیم وجود Cu 2+ در مرکز فعال است. مولکول های لیزیل اکسیداز در سلول به عنوان پروآنزیم سنتز می شوند و پس از اتصال به یون های Cu 2+ در وزیکول هایی بسته بندی می شوند که سلول را ترک می کنند. در سطح سلول، مولکول پرولیزیل اکسیداز تحت پروتئولیز محدودی قرار می گیرد و در مرکز فعال تشکیل شده، با مشارکت یون های Cu 2+، باقی مانده تیروزین به تیروزین کینون اکسید می شود. ساختار کینوئیدی تشکیل شده در مرکز فعال، بقایای لیزین را در مولکول پروکلاژن متصل می کند تا یک کمپلکس آنزیم-سوبسترا تشکیل دهد. دآمیناسیون بیشتر لیزین مطابق با واکنش های ارائه شده در شکل 1 رخ می دهد. 1.10.
در مرحله بعد، آلیزین و 5-هیدروکسی آلیزین همراه با باقی مانده های لیزیل و هیدروکسی لیزیل متراکم می شوند. پیوندهای عرضی درون و بین مولکولی تشکیل می شود. در واکنش

برنج. 1.10.اکسیداسیون لیزین در ساختار کلاژن:
1 - تشکیل یک مجتمع آنزیم-سوبسترا؛ 2 - NH 3+ به تیروزین کینون (LTQ) منتقل می شود و لیزین با جابجایی بعدی آلیزین از مرکز فعال اکسید می شود. 3 - مولکول های O 2 و H 2 O وارد مرکز فعال آنزیم شده و NH 3 و H 2 O 2 آزاد می شوند. در این صورت LTQ به حالت اولیه خود (Enz - enzyme) برمی گردد.
تراکم آلیزین با باقیمانده لیزین یک زنجیره دیگر، یک پایه شیف تشکیل می شود. در صورت تراکم آلدول دو باقیمانده آلیزین، پیوندهای بین مولکولی آلدول (لیزین نورلوسین) تشکیل می شود. شکل گیری پیوندهای بین مولکولی آلدول در شکل نشان داده شده است. 1.11.
تراکم آلدول مشخصه کلاژن استخوان و عاج است، در حالی که بازهای شیف در کلاژن های تاندون شایع ترین هستند.
حدود 25 درصد از مولکول های تروپوکلاژن بدون تشکیل فیبریل تجزیه می شوند. قطعات حاصل عملکردهای سیگنالینگ را انجام می دهند و کلاژن زایی را تحریک می کنند. سازماندهی فضایی فیبریل ها با مشارکت فیبرونکتین، پروتئوگلیکان ها و کلاژن های مرتبط با فیبریل ها تکمیل می شود.

پیوندهای بین مولکولی آلدول
برنج. 1.11.اکسیداسیون لیزین و تشکیل پیوند بین مولکولی آلدول در واکنش های تراکم آلدول دو باقیمانده آلیزین.
نقض سنتز پروتئین های کلاژن در انسان
هر گونه نقض در سنتز پروتئین های کلاژن از نظر بالینی، اول از همه، با تغییر در سیستم دندانی آلوئولار به شکل خونریزی لثه، تحرک و از دست دادن دندان ها، پوسیدگی های متعدد آشکار می شود. دلایلی که منجر به نقض سنتز پروتئین های کلاژن می شود متفاوت است - کمبود اسید اسکوربیک در بدن، یون های Cu 2+، نقص های ژنتیکی و شرایط خود ایمنی.
هیدروکسیلاسیون لیزین و پرولین، بسته به مقدار اسید اسکوربیک، مرحله بسیار مهمی برای تشکیل پیوندهای کووالانسی بعدی بین مولکول های کلاژن و تجمع فیبرهای کلاژن است. در بیماری اسکوربوت، بیماری ناشی از کمبود اسید آسکوربیک، هیدروکسیل شدن پرولین و باقی مانده های لیزین در ساختار پروکلاژن آسیب می بیند. در نتیجه عروق شکننده و شکننده تشکیل می شوند. نقض سنتز کلاژن در پالپ و عاج منجر به ایجاد پوسیدگی های متعدد می شود، رباط های پریودنتال آسیب می بینند.
پدیده های مشابه در کمبود مادرزادی لیزیل هیدروکسیلاز (سندرم اهلرز-دانلو-روساکوف، نوع IV) رخ می دهد. حلالیت بالای مولکول های کلاژن در نقص مادرزادی لیزیل اکسیداز (سندرم اهلرز-دانلوس، نوع V) یا نقض متابولیسم مس (بیماری منکس) آشکار می شود که با نقض تشکیل پیوندهای متقابل بین کلاژن همراه است. میکروفیبریل ها این امر منجر به بدتر شدن خواص مکانیکی لیگامان های پریودنتال، وضعیت بافت های پریودنتال، شلی پوست و بروز نقص در رشد اسکلت در افراد مبتلا به این بیماری می شود.
در دیابت شیرین به دلیل ناتوانی سلول ها در جذب گلوکز از پلاسمای خون، روند گلیکوزیلاسیون داخل سلولی زنجیره های آلفا پروکلاژن مختل می شود. هنگامی که پروکلاژن وارد فضای داخل سلولی می شود، کربوهیدرات ها به روشی غیر آنزیمی به هم متصل می شوند که ساختار فیبرهای کلاژن و پروتئین های غیر کلاژنی را نیز مختل می کند. یک نوع شدید پریودنتیت ایجاد می شود که درمان آن دشوار است. در کودکان متولد شده از مادران مبتلا به دیابت قندی وابسته به انسولین، هیپوپلازی سیستمیک بافت های سخت دندان تشخیص داده می شود.
نقض ساختار غشای پایه زمانی اتفاق میافتد که آنتیبادیهای پروتئینهایی که ساختار ساختاری غشای پایه را تشکیل میدهند (سندرم گودپاسچر)، یا جهشهایی در ژن کدکنندهی زنجیرههای α کلاژن نوع IV (سندرم آلپورت) ظاهر میشوند. در این اشکال آسیب شناسی، همراه با آسیب به کلیه ها و سایر اندام ها، ضایعات غیر پوسیدگی بافت های سخت دندان (هیپوپلازی مینا، کاهش حجم و اختلال در ساختار عاج) و تغییرات دژنراتیو در بافت های نرم حفره دهان مشاهده می شود.
برای مطالعه متابولیسم کلاژن در ادرار و پلاسمای خون، غلظت هیدروکسی پرولین، پرولین، میزان محصولات تخریب کلاژن نوع I - تلوپپتیدهای N و C تعیین می شود. یک شاخص مشخصه تجزیه کلاژن افزایش مقدار هیدروکسی پرولین در پلاسمای خون و ادرار و همچنین افزایش مقدار N- و C-تلوپپتید در پلاسمای خون و محتوای کلسیم تعیین شده در ادرار در خون است. صبح قبل از غذا افزایش میزان پرولین در پلاسمای خون نشان دهنده نقض بلوغ کلاژن است.
علاوه بر پروتئین های کلاژن، ماتریکس خارج سلولی همچنین حاوی پروتئین های غیر کلاژنی - الاستین، پروتئوگلیکان ها، گلیکوپروتئین ها و غیره است.
1.3. ساختار و خواص پروتئین های غیرکلاژنی
الاستین
در ماده بین سلولی دیواره رگ های خونی، بافت های پریودنتال، ریشه زبان، در لایه زیر مخاطی لب ها و گونه ها، ریه ها و پوست، الیاف الاستین به مقدار زیاد وجود دارد. این پارچه ها خواص بسیار مهمی دارند: می توانند چندین برابر طول اولیه خود کشیده شوند و در عین حال استحکام کششی بالایی داشته باشند و پس از برداشتن بار به حالت اولیه برگردند. خواص لاستیک مانند این بافت ها توسط پروتئین اصلی الاستین - یک گلیکوپروتئین با یک مول - ارائه می شود. با وزن 70 کیلو دالتون
الاستین حاوی حدود 27٪ گلیسین، 19٪ آلانین، 10٪ والین، 4.7٪ لوسین است. وجود تعداد زیادی رادیکال های آبگریز از ایجاد یک گلبول پایدار جلوگیری می کند؛ در نتیجه، زنجیره های پلی پپتیدی الاستین ساختارهای ثانویه و سوم منظمی را تشکیل نمی دهند، اما ترکیبات متفاوتی را در ماتریکس بین سلولی با انرژی آزاد تقریبا برابر به خود می گیرند (شکل 1.12). ).

برنج. 1.12.قطعه ای از زنجیره پلی پپتیدی الاستین.
الیاف الاستین بومی از مولکولهای نسبتاً کوچک و تقریباً کروی شکل ساخته شدهاند که با کمک پیوندهای متقابل سفت و سخت - دزموزین و ایزودزموزین و همچنین لیزینورلوسین به رشتههای فیبری متصل میشوند. 4 باقیمانده لیزین در تشکیل پیوندهای متقابل نقش دارند که 3 تای آنها با مشارکت لیزیل اکسیداز به آلدئیدهای مربوطه از قبل اکسید می شوند. دزموزین و ایزودزموزین توسط بقایای متعلق به حداقل دو زنجیره تشکیل می شوند، اما می توانند توسط باقی مانده های واقع در سه و چهار زنجیره نیز تشکیل شوند. 2 باقیمانده لیزین در تشکیل لیزین نورلوسین نقش دارند (شکل 1.13).

برنج. 1.13.پیوندهای عرضی در ساختار الاستین: آ- دزموزین، که توسط چهار باقی مانده لیزین تشکیل شده است. ب- لیزین نورلوسین، که توسط دو باقی مانده لیزین تشکیل می شود.
تشکیل پیوندهای کووالانسی بین زنجیرههای پپتیدی الاستین با یک ترکیب تصادفی به شبکه الیاف الاستین اجازه میدهد تا در همه جهات کشیده و منقبض شوند که به آنها خاصیت ارتجاعی میدهد (شکل 1.14).
سنتز و تجزیه الاستین . سنتز الاستین در فیبروبلاست ها با تشکیل یک پیش ماده الاستین، پروتئین تروپولاستین آغاز می شود. تروپولاستین یک مونومر محلول است که نواحی آبدوست آن با بقایای لیزین غنی شده است. در ماتریکس بین سلولی، با مشارکت لیزیل اکسیداز وابسته به مس، بقایای لیزین به آلیزین اکسید می شوند که پیوندهای متقابل ایجاد می کنند که مولکول الاستین را تثبیت می کند. پس از اتصال عرضی، الاستین شکل نهایی خارج سلولی خود را به خود می گیرد که با نامحلول بودن، پایداری بالا و سرعت متابولیسم پایین مشخص می شود.
در تجزیه الاستین، الاستاز لکوسیتهای پلیمورفونوکلئر دخیل است که به عنوان یک اندوپپتیداز، عمدتاً پراکنده میشود.

برنج. 1.14.مدل ساختاری الاستین:
آ- حالت آرامش؛ ب- حالت کشش
پیوندهای تشکیل شده توسط گروه های کربوکسیل اسیدهای آمینه آلیفاتیک را می شکند. در یک محیط کمی قلیایی (pH 7.5-8.5) فعال است و در فضای خارج سلولی نه تنها الاستین، بلکه سایر پروتئین ها - پروتئوگلیکان ها، هموگلوبین، کلاژن، ایمونوگلوبولین ها، هیدرولیز می شود. فعالیت الاستاز پروتئین α1-آنتی تریپسین (α1-AT) را مهار می کند. بیشترین مقدار α 1 -AT توسط کبد سنتز می شود و در خون یافت می شود. در بافت ها، α1-AT توسط ماکروفاژها سنتز می شود.
تغییرات در ساختار الاستین در طی فرآیندهای پاتولوژیک
با نقض تشکیل دسموسین ها، ایزودزموزین ها و لیزین-نورلوسین، استحکام کششی بافت های الاستیک کاهش می یابد، مواردی مانند نازکی، بی حالی، کشش ظاهر می شود، یعنی خواص پلاستیکی آنها از بین می رود. تغییرات در ساختار الاستین ممکن است به دلیل کاهش فعالیت لیزیل اکسیداز در بیماری های ارثی و اکتسابی، کمبود مس باشد. نقض ساختار الاستین می تواند با تغییرات قلبی عروقی به شکل آنوریسم و پارگی آئورت، نقص دریچه قلب، ذات الریه مکرر و آمفیزم آشکار شود.
الاستاز در بافت لثه فعال نیست. با ایجاد التهاب، تعداد لکوسیت های پلی مورفونکلئر افزایش می یابد و آنها به منبع الاستاز تبدیل می شوند. افزایش مقدار دومی در پس زمینه محتوای بدون تغییر یا کاهش یافته α1-AT در بافت های لثه رخ می دهد. عدم تعادل بین آنزیم و مهارکننده آن منجر به تخریب الیاف الاستیک در ژنژیویت و پریودنتیت می شود.
پروتئوگلیکان ها و گلیکوزآمینوگلیکان ها
پروتئوگلیکان ها- دسته ای از پروتئین های پیچیده ماتریکس خارج سلولی. آنها از پروتئین های هسته ای (هسته ای) مختلفی تشکیل شده اند که الیگوساکاریدهای مرتبط با زنجیره های گلیکوزآمینوگلیکان از طریق پیوندهای N- و O-گلیکوزیدی به آنها متصل می شوند (شکل 1.15).
برنج. 1.15.ساختار پروتئوگلیکان

پروتئوگلیکان های مختلف از نظر اندازه مولکولی، محتوای پروتئین نسبی و مجموعه گلیکوزامینوگلیکان ها متفاوت هستند. پروتئوگلیکان ها به مقدار زیاد در عاج، پالپ، سیمان، بافت های پریودنتال، غشاهای مخاطی حفره دهان وجود دارند (جدول 1.2).
برخی از پروتئوگلیکان ها - سرگلیسین، پروتئوگلیکان ماتریکس غضروف، دکورین، ورسیکان و غیره در حالت محلول هستند و در ماتریکس خارج سلولی موضعی دارند. پروتئوگلیکان های دیگر، مانند syndecan، با انتگرال های گذرا نشان داده می شوند. جدول 1.2
پروتئوگلیکان ها و گلیکوزآمینوگلیکان ها در بافت های دهان

پروتئین های ny Syndecan دارای دامنه های گذرا و سیتوپلاسمی خارج سلولی است و با اسکلت سلولی اکتین تعامل دارد. در خارج، روی سطح سلول، syndecan به فیبرونکتین و سایر اجزای ماتریکس خارج سلولی متصل می شود.
مولکول های گلیکوزامینوگلیکان ها در اتصال پروتئوگلیکان ها به پروتئین های خاص نقش دارند. گروه های دارای بار منفی آنها با رادیکال های دارای بار مثبت اسیدهای آمینه لیزین و آرژنین واقع در نواحی خاصی از مولکول پروتئین تعامل دارند. به این ترتیب، گلیکوزامینوگلیکان های سولفاته بالا به فیبرونکتین متصل می شوند.
پروتئوگلیکان ها به عنوان گیرنده در مونتاژ ماتریکس خارج سلولی عمل می کنند، اتصال سلولی را تسهیل می کنند و فرآیندهای رشد سلولی را تنظیم می کنند. آنها همچنین می توانند با پروتئین های خاصی مانند فاکتورهای رشد کمپلکس تشکیل دهند. در کمپلکس های حاصل، پروتئین ها از آنزیم های پروتئولیتیک محافظت می شوند. این مجموعه ها به عنوان مخزن عمل می کنند و تنها در صورت لزوم عامل رشد از آنها خارج می شود و توانایی نمایش فعالیت بیولوژیکی خود را به دست می آورد.
گلیکوزامینوگلیکان ها متعلق به هتروپلی ساکاریدها است. اینها ساختارهای خطی هستند که از واحدهای دی ساکارید تکرار شونده ساخته شده اند. مولکول دی ساکارید از یک اسید اورونیک و یک قند آمینه تشکیل شده است که گروه آمینه آن معمولاً استیله است. وجود گروه های سولفات و کربوکسیل در گلیکوزامینوگلیکان ها به آنها بار منفی زیادی می دهد و توانایی اتصال به آب را به آنها می دهد. به دلیل چگالی زیاد بار منفی روی سطح آنها، کاتیون های Ca 2 + , Na + , K + را به هم متصل می کنند و بنابراین در متابولیسم معدنی شرکت می کنند.
تمام گلیکوزامینوگلیکان ها به دو گروه سولفاته و غیر سولفاته تقسیم می شوند. گلیکوزامینوگلیکان های غیر سولفاته شامل اسید هیالورونیک.گلیکوزامینوگلیکان های سولفاته به شکل آزاد وجود ندارند. هنگامی که با مقدار کمی پروتئین همراه هستند، پروتئوگلیکان ها را تشکیل می دهند. ساختار واحدهای دی ساکارید که گلیکوزآمینوگلیکان ها را می سازند در شکل نشان داده شده است. 1.16.
اسید هیالورونیک در بسیاری از اندام ها و بافت ها یافت می شود. از بقایای دی ساکارید که با پیوندهای β-(1-> 4)-گلیکوزیدی متصل شده اند ساخته شده است. قطعات دی ساکارید به نوبه خود شامل بقایای اسید β-D-گلوکورونیک و N-استیل-(3-D-گلوکوزامین) هستند که توسط پیوندهای β-(1-3)-گلیکوزیدی به هم مرتبط شده اند. اسید هیالورونیک دارای

برنج. 1.16.ساختار واحدهای دی ساکارید تکراری در گلیکوزامینوگلیکان ها
اسکله مرتفع جرم (آقای 10 5 -10 7 بله). در تعدادی از اندام ها (بدن زجاجیه چشم، بند ناف، مایع مفصلی) به صورت آزاد است و در غضروف، تجمعات پروتئوگلیکان را تشکیل می دهد. در مایع مفصلی، اسید هیالورونیک نقش یک روان کننده را ایفا می کند و اصطکاک بین سطوح مفصلی را کاهش می دهد. در فرآیند رشد جنین، فضاهای بین سلولی را پر می کند و حرکت سلول ها را تسهیل می کند. در مقادیر زیاد، اسید هیالورونیک در طول بهبود زخم سنتز می شود. با اتصال آب، یک عملکرد مانع را فراهم می کند.
زنجیره های اسید هیالورونیک قادر به انعقاد هستند، مقادیر زیادی آب را متصل کرده و یک دامنه تشکیل می دهند. به این دامنه (تعریف شده است
فضا) به مولکول ها یا یون های کوچک دسترسی دارند، اما مولکول های بزرگ (آلبومین، ایمونوگلوبولین ها) قادر به نفوذ به داخل آن نیستند. دامنه ها قادر به تماس، جمع شدن و نفوذ به یکدیگر هستند که ویسکوزیته بالای محلول را تعیین می کند.
کندرویتین سولفات حاوی واحدهای دی ساکارید تکرار شونده است که با پیوندهای β-(1->4) -گلیکوزیدی متصل شده اند. دی ساکاریدها از اسید گلوکورونیک و N-استیل گالاکتوزامین سولفاته ساخته شده اند که توسط پیوندهای (3-(1-3)-گلیکوزیدی به هم مرتبط هستند. بسته به موقعیت گروه سولفات، کندرویتین-4-سولفات و کندرویتین-6-سولفات متمایز می شوند. زنجیره پلی ساکارید کندرویتین سولفات حاوی حدود 40 واحد دی ساکارید تکرار شونده است. جرم مولکولی کندرویتین سولفات از 10 تا 600 کیلو دالتون متغیر است. علیرغم تفاوت های اندک در ساختار شیمیایی، کندرویتین سولفات ها به طور قابل توجهی در خواص فیزیکوشیمیایی و توزیع در انواع مختلف بافت پیوندی متفاوت هستند. -4-سولفات عمدتاً در ترکیب غضروف و بافت های استخوانی، قرنیه چشم و کندرویتین-6-سولفات در تاندون ها، رباط ها، بند ناف و همچنین در استخوان ها وجود دارد.
سولفات درماتان - هتروپلی ساکارید از نظر ساختار شبیه به کندرویتین سولفات است. در مقابل دومی، قطعه دی ساکارید درماتان سولفات حاوی یک باقیمانده اسید L-iduronic به جای اسید D-glucuronic است. سولفات درماتان در پوست، غضروف، تاندون ها و دیسک های بین مهره ای، رگ های خونی و دریچه های قلب وجود دارد. به عنوان بخشی از پروتئوگلیکان های کوچک (بی گلیکاکان و دکورین)، در ماده بین سلولی استخوان ها، غضروف ها، دیسک های بین مهره ای و منیسک ها یافت می شود، جایی که در تثبیت رشته های کلاژن شرکت می کند.
سولفات کراتان - ناهمگن ترین گلیکوزامینوگلیکان ها؛ از نظر محتوای کل کربوهیدرات ها و توزیع در بافت های مختلف با یکدیگر متفاوت هستند. برخلاف سایر گلیکوزامینوگلیکان ها، کراتان سولفات ها به جای اسید اورونیک، حاوی باقیمانده دی گالاکتوز هستند. باقی مانده های D-گالاکتوز در قطعات دی ساکارید کراتان سولفات توسط پیوندهای β-(1->4) -گلیکوزیدی به باقی مانده های N-استیل-D-گلوکوزامین-6-سولفات متصل می شوند. قطعات دی ساکارید توسط پیوندهای β-(1->3) -گلیکوزیدی به هم متصل می شوند.
کراتان سولفات قرنیه 1 علاوه بر واحد دی ساکارید تکرار شونده، حاوی L-fucose، D-mannose و اسید سیالیک است. کراتان سولفات 2 در غضروف، استخوان ها و دیسک های بین مهره ای یافت می شود. سولفات های کراتان بخشی از پروتئوگلیکان بزرگ - آگرکان و برخی پروتئوگلیکان های کوچک ماتریکس غضروف هستند.
هپاران سولفات یک هتروپلی ساکارید ساخته شده از اسید گلوکورونیک و N-acetylglucosamine است. حاوی گروه های N-آسیل بیشتر و سولفات کمتری است. این بخشی از پروتئوگلیکان های غشای پایه است و جزء ثابت سطح سلول است.
پروتئوگلیکان های بزرگ
به پروتئوگلیکان های بزرگشامل پروتئین هایی با مول بزرگ است. با وزن بیش از 100 زنجیره گلیکوزامینوگلیکان. این گروه شامل آگرکان، ورسیکان، نوروکان، برویکان و ... می باشد که ویژگی آنها قابلیت اتصال به کلاژن ها، اسید هیالورونیک و تشکیل دانه های پروتئوگلیکان است.
یک پروتئوگلیکان بزرگ حاوی کندرویتین سولفات در سمنتوم، پالپ دندان، غشای مخاطی، بافت استخوانی و پوست وجود دارد. ورسیکان ، میگویند. که جرم آن حدود 1000 کیلو دالتون است. پروتئین هسته ورسیکان از توالی اسیدهای آمینه حاوی باقیمانده های گلو-گلیفن تشکیل شده است. به دلیل محتوای بالای سولفات، اسید گلوتامیک و ارتباط با اسید هیالورونیک، ورسیکان در حالت هیدراته فضای قابل توجهی را اشغال می کند.
ماتریکس غضروف با حضور یک پروتئوگلیکان بزرگ دیگر مشخص می شود - آگرکانا (نگاه کنید به غضروف).
پروتئوگلیکان های کوچک
پروتئوگلیکان های کوچک دارای یک پروتئین هسته کوچک هستند که 1 یا 2 زنجیره گلیکوزامینوگلیکان به آن متصل است. پروتئوگلیکان های کوچک شامل پروتئوگلیکان های غنی از لوسین، پروتئوگلیکان های مرتبط با سلول و پروتئوگلیکان های غشای پایه هستند.
پروتئوگلیکان های غنی از لوسین . یکی از ویژگی های پروتئوگلیکان های کوچک این خانواده وجود 9-12 دامنه غنی از لوسین در ناحیه C ترمینال پروتئین هسته است. این دامنه ها دارای خاصیت اتصال کلاژن هستند. ناحیه N ترمینال در توالی اسید آمینه خود بسیار متغیر است که با گلیکوزآمینوگلیکان ها مرتبط است. دامنه های ناحیه N ترمینال در برهمکنش پروتئین ها با یکدیگر و با سلول ها نقش دارند.
پروتئین های این خانواده با دکورین، بیگلیکان، فیبرومودولین، لومیکان، استئوآدرین، استئوگلیسین، اکولوگلیکان، اپتیکین و آسپورین نشان داده می شوند.
پروتئوگلیکان های کوچک - فیبرومودولین، لومیکان و استئوآدرین در ناحیه N ترمینال حاوی زنجیره هستند. کراتان سولفاتکه در حال پیوستن هستند آسپاراژینو همچنین بقایای سولفاته تیروزین.
فیبرومودولین - پروتئوگلیکان با یک مول با وزن حدود 40 کیلو دالتون نشان داده شده است که فیبرومودولین به فیبرهای کلاژن نوع II می چسبد و قطر آنها را محدود می کند.
لومیکان ساختار آن بسیار شبیه فیبرومودولین است. در ماتریکس بین سلولی بافت های عضلانی و غضروفی، ریه ها، روده کوچک، قرنیه وجود دارد. قرار است در تنظیم تشکیل یک ساختار کلاژن مشبک نقش داشته باشد.
استئوآدرین - پروتئین با مول وزن 49.1 کیلو دالتون از ویژگی های این پروتئین وجود چهار باقیمانده تیروزین سولفاته است که سه تای آنها در ناحیه N ترمینال قرار دارند. ناحیه C ترمینال حاوی تعداد زیادی اسید آمینه با بار منفی است. مولکول استئوآدرین توسط استئوبلاست های بالغ و همچنین توسط ادونتوبلاست ها سنتز می شود. در لایه آملوبلاستیک در مرحله بلوغ مینای دندان مشخص می شود و در فرآیندهای کانی سازی نقش دارد.
دکورین و بیگلیکان از نظر اندازه و ساختار مشابه هستند، اما سنتز آنها تحت کنترل ژن های مختلف است. مول. جرم دکورین حدود 130 کیلو دالتون و جرم بیگلیکان حدود 270 کیلو دالتون است. پروتئین های هسته آنها حاوی یک توالی اسید آمینه عجیب و غریب غنی از لوسین است که 10 بار در دکورین و 12 بار در بیگلیکان تکرار می شود. بیگلیکان حاوی سرین در موقعیت های 5 و 11 و دکورین در موقعیت 4 است که به بیگلیکان اجازه می دهد 2 زنجیره پلی ساکارید را بچسباند و تنها یکی را دکورین کند (شکل 1.17). این پروتئوگلیکان ها دارای زنجیره های پلی ساکارید هستند سولفات درماتاندکورین و بیگلیکان در برهمکنشهای بین سلولی نقش دارند که میتواند توسط (3-ساختار در پروتئین هسته) تسهیل شود. نشان داده شده است که دکورین و احتمالاً بیگلیکان با β فاکتور رشد تبدیل کننده (TGF-(3).
محلی سازی دکورین با محل کلاژن همزمان است. اگر هدف بیگلیکان ناشناخته باشد، دکورین در اتصال به کلاژن نوع I و II نقش دارد و همچنین فیبرینولیز را مهار می کند. علاوه بر این، بیگلیکان و دکورین تعاملات بین سلول ها، الاستین و پروتئین های چسبنده - فیبرونکتین و لامینین را فراهم می کنند.
پروتئوگلیکان های مرتبط با سلول
در طول رشد سلولی، پروتئوگلیکان های کوچک ظاهر می شوند که به آنها پروتئوگلیکان های مرتبط با سلول می گویند. این خانواده از پروتئین ها شامل سرگلیسین ها، سیندکان ها، بتاگلیسین ها، ترومبومودولین، فسفاتیدیلینوزیتول - پروتئوگلیکان های لنگر می باشد.

برنج. 1.17.ساختار دامنه پروتئوگلیکان های کوچک: آ -دکورین ; ب -بیگلیکان ; V -فیبرومودولین .
Syndecans شامل 4 نوع پروتئین مختلف است. آنها پروتئوگلیکان های یکپارچه هستند و دارای حوزه های درون سلولی، ترانس غشایی و خارج سلولی هستند. حوزه خارج سلولی این پروتئین ها مشابه حوزه پروتئینازها بوده و قادر به بازکردن غشای سلولی است و همچنین حاوی زنجیره های مختلفی از گلیکوزامینوگلیکان های متصل به سیندکان است. بنابراین، syndecans 1 و 3 حاوی هپاران سولفات و کندرویتین سولفات است. Syndecan-1 در سلول های اپیتلیال در طول توسعه ظاهر می شود، Syndecan-2 (فیبروگلیکان) توسط سلول های فیبروبلاست و سلول های کبدی سنتز می شود. syndecan-3 (N-syndecan) در بافت عصبی و غضروف در حال رشد وجود دارد و syndecan-4 (ریودوکان، آمفیگلیکان) در اندوتلیوم، اپیتلیوم، سلولهای ماهیچه صاف و فیبروبلاستهای پوست وجود دارد. Syndecan ها کلاژن ها، فیبرونکتین، ترومبوسپوندین، تناسین و فاکتور رشد فیبروبلاست را از طریق حوزه های خارج سلولی متصل می کنند. حوزه های درون سلولی syndecan از طریق اکتین به اسکلت سلولی متصل می شوند.
سرگلیسین ها جدا شده از وزیکول های ترشحی ترکیب آنها به نوع سلول و تمایز سلولی بستگی دارد. زنجیرههای کندرویتین و سولفات هپاران با پروتئین اصلی مرتبط هستند. یکی از ویژگی های مولکول های سرگلیسین محتوای بالای باقی مانده های سولفات است که آنها را در برابر پروتئولیز مقاوم می کند. مول. جرم سرگلیسین ها به طور گسترده ای متفاوت است (60-750 کیلو دالتون)، و آنها می گویند. جرم پروتئین هسته عملا و ثابت است (16-18 کیلو دالتون).
اعتقاد بر این است که سرگلیسین ها در تنظیم فعالیت آنزیمی گرانول های ترشحی و تمایز سلول های خونساز نقش دارند.
برخی از سرگلیسین ها توسط سلول های اندوتلیال سنتز می شوند و سنتز آنها تحت تأثیر فاکتور نکروز تومور و اینترلوکین 1α (IL-1α) افزایش می یابد. سرگلیسین ممکن است در مهاجرت لکوسیت ها در طی فرآیندهای التهابی نقش داشته باشد. اخیراً مشخص شده است که همراه با سایر پروتئوگلیکان ها در چسبندگی و فعال شدن سلول های لنفاوی نقش دارند.
پروتئوگلیکان های غشای پایه
یک گروه کامل از پروتئوگلیکان های ناهمگن حاوی هپاران سولفات در غشاهای پایه شناسایی شده است. ساختار پروتئین هسته شامل حوزه های کروی است که توسط قطعات میله ای از هم جدا شده اند. دامنه های گلوبولار ارتباط این پروتئوگلیکان ها را با کلاژن نوع IV، لامینین و سایر گلیکوپروتئین ها و همچنین با سلول های واقع در غشای پایه فراهم می کنند.
اصلی حاوی هپاران سولفاتپروتئوگلیکان غشای پایه است پرلکان . زنجیره پلی پپتیدی، متشکل از 3500 باقی مانده اسید آمینه، از طریق گروه های هیدروکسیل به سه زنجیره سولفات هپاران متصل می شود. سریندر ناحیه ترمینال N هر زنجیره پلی ساکارید حاوی 200 مونومر است. حدود سه دوجین حوزه کروی در مولکول پرلکان تعریف شده است که توسط قطعات میله مانند کوتاه از هم جدا شده اند و ارتباط بین سلول ها و اجزای ماتریکس خارج سلولی را فراهم می کنند.
حفظ ویژگی های بیومکانیکی و فیزیولوژیکی بافت همبند تا حد زیادی با حفظ تعادل بین فرآیندهای بیوسنتز و تخریب کلاژن ها و پروتئوگلیکان ها تعیین می شود. تجزیه و سنتز پروتئوگلیکان ها توسط: 1) هورمون ها - سوماتوتروپین، تیروکسین، انسولین تنظیم می شود. 2) سیتوکین ها - IL-1، کشکتین ها. 3) ویتامین های گروه A و C؛ 4) عناصر کمیاب؛ 5) عوامل رشد
سنتز پروتئوگلیکان ها
سنتز پروتئوگلیکان ها با بیوسنتز پروتئین هسته روی پلی ریبوزوم ها آغاز می شود. در حال حاضر در فرآیند ترجمه پروتئین در شبکه آندوپلاسمی خشن، تری ساکاریدها از طریق گروه های آمیدی باقی مانده های آسپاراژین متصل می شوند. الیگوساکاریدهای مرتبط با دولیکول با محتوای مانوز بالا به عنوان دهنده الیگوساکارید عمل می کنند. پس از افزودن الیگوساکاریدهای مرتبط با N، پروتئین هسته تحت زایلوزیلاسیون و فسفوریلاسیون قرار می گیرد. UDP-xylosate-
رانسفراز، که انتقال باقی مانده های زایلوز را به گروه هیدروکسیل پروتئین هسته انجام می دهد، یکی از آنزیم های کلیدی در بیوسنتز پروتئوگلیکان ها است. فرآیندهای بعدی تشکیل زنجیره های گلیکوزامینوگلیکان ها در دستگاه گلژی رخ می دهد. زنجیره های پلی ساکارید گلیکوزآمینوگلیکان ها با افزودن متوالی مونوساکاریدها، که اهداکنندگان آن معمولاً قندهای UDP مربوطه هستند، سنتز می شوند. گلیکوزیل ترانسفرازها بر روی غشاهای دستگاه گلژی قرار می گیرند که با مشارکت آن مولکول پروتئین تحت گلیکوزیلاسیون قرار می گیرد (شکل 1.18).

برنج. 1.18.اتصال گلیکوزامینوگلیکان به پروتئین هسته از طریق یک تری ساکارید اتصال. یک الیگوساکارید اتصال متشکل از دو باقیمانده گالاکتوز و یک باقیمانده گزیلوز از طریق یک پیوند O- یا N-گلیکوزیدی به سرین، ترئونین یا آسپاراژین متصل می شود.
UDP-گالاکتوزیل ترانسفراز I اولین بقایای گالاکتوز را به زایلوز منتقل می کند، UDP-گالاکتوزیل ترانسفراز II باقیمانده گالاکتوز دوم را منتقل می کند و تشکیل تری پپتید اتصال با چسباندن یک باقیمانده اسید گلوکورونیک به آن تکمیل می شود. این واکنش توسط UDP-glucuronyltransferase I کاتالیز می شود. سنتز بیشتر زنجیره پلی ساکارید با افزودن متوالی N-acetylgalactosamine (یا N-acetylglucosamine, galactose) و اسید گلوکورونیک (یا iduronic) انجام می شود (شکل 1.19).
اصلاح زنجیره های گلیکوزامینوگلیکان سولفاته شدن است، یعنی افزودن سولفات به C-4 و (یا) به C-6 N-acetylga-.


برنج. 1.19.سنتز کندرویتین سولفات به عنوان بخشی از پروتئوگلیکان. آنزیم ها: 1 - UDP-xylosyltransferase. 2 - UDP-گالاکتوزیل ترانسفراز I. 3 - UDPgalactosyltransferase II; 4 - UDP-glucuronyltransferase I. 5 - UDP-N-استیل گالاکتوزامین ترانسفراز I. 6 - UDP-glucuronyltransferase II; 7 - UDP-N-استیل گالاکتوزامین ترانسفراز II. 8 - سولفوترانسفراز

برنج. 1.20.واکنش سولفاته شدن باقیمانده N-acetylgalactosamine در طول سنتز زنجیره سولفات کندرویتین.
لاکتوزامین سولفات توسط سولفوترانسفرازهای خاص به مولکول پذیرنده منتقل می شود (شکل 1.20). دهنده گروه سولفات 3"-phosphoadenosine-5"-phosphosulfate (FAPS) است.
قندهای آمینه و اسیدهای هگزورونیک از گلوکز سنتز می شوند. پیش ساز فوری N-acetylglucosamine و N-acetylgalactosamine فروکتوز-6-فسفات است. منبع گروه NH2 برای قندها گلوتامین است. آمینو قند حاصل بیشتر با استیل کوآ استیله می شود (شکل 1.21).

برنج. 1.21.سنتز گلیکوزامینوگلیکان ها
آنزیم ها: 1 - هگزوکیناز؛ 2 - فسفوگلوکایزومراز؛ 3 - آمینوترانسفراز؛ 4 - استیل ترانسفراز؛ 5 - N-acetylglucosamine phosphomutase; 6 - UDP-N-استیل گلوکوزامین پیروفسفوریلاز؛ 7 - اپی مراز؛ 8 - UDP - گلوکوزامین پیروفسفوریلاز؛ 9 - UDP-گلوکوپیروفسفوریلاز؛ 10 - UDP گلوکز دهیدروژناز.
در واکنش های epimerization، پس از ادغام گلوکورونات در زنجیره کربوهیدرات، اسید L-iduronic از D-glucuronic اسید تشکیل می شود.
سنتز گلیکوزآمینوگلیکان ها تحت تأثیر سوماتوتروپین و رتینوئیک اسید است که ترکیب سولفات را در مولکول ها فعال می کند. در مقابل، سنتز اسید هیالورونیک و گلیکوزامینوگلیکان های سولفاته توسط گلوکوکورتیکوئیدها و هورمون های جنسی مهار می شود.
تجزیه پروتئوگلیکان ها
تجزیه پروتئوگلیکان ها یک فرآیند فیزیولوژیکی است که شامل تجدید منظم ماکرومولکول های خارج سلولی و درون سلولی است. پروتئین ها و گلیکوزیدازها در تخریب پروتئوگلیکان ها نقش دارند. در ابتدا، هسته و پروتئین های اتصال دهنده در معرض رادیکال های آزاد قرار می گیرند و در ماتریکس بین سلولی توسط متالوپروتئینازهای ماتریکس - کلاژناز، ژلاتیناز، استروملیزین هیدرولیز می شوند. پروتئینازها پروتئین هسته را می شکافند و گلیکوزیدازها زنجیره های گلیکوزآمینوگلیکان ها و الیگوساکاریدها را هیدرولیز می کنند. تمام پروتئوگلیکان های حاوی کندرویتین سولفات، درماتان سولفات، هپاران سولفات و زنجیره سولفات کراتان در ابتدا به قطعات تقسیم می شوند. سپس قطعات پروتئوگلیکان ها توسط سلول های بلاست گرفته شده و در معرض تخریب درون سلولی قرار می گیرند. این قطعات همچنین می توانند همراه با لنف و خون به کبد منتقل شوند. در هپاتوسیت ها، هیدرولیز بیشتر آنها اتفاق می افتد که در آن آسپارتیل، سرین و سایر پروتئینازها شرکت می کنند.
تجزیه گلیکوزامینوگلیکان ها
گلیکوزامینوگلیکان ها با نرخ متابولیک بالا متمایز می شوند: نیمه عمر (T 1/2) بسیاری از آنها از 3 تا 10 روز است و فقط برای کراتان سولفات T 1/2 - 120 روز است. تخریب زنجیره های پلی ساکارید شامل اگزو- و اندوگلیکوزیدازها (هیالورونیداز، (3-گلوکورونیداز، (3-گالاکتوزیداز، (3-ایدورونیداز)) و سولفاتازها می شود.
گلیکوزامینوگلیکان ها با مکانیسم اندوسیتوز از فضای خارج سلولی وارد سلول می شوند، جایی که وزیکول های اندوسیتی با لیزوزوم ها ادغام می شوند. آنزیم های لیزوزومی فعال هیدرولیز تدریجی گلیکوزامینوگلیکان ها را به مونومرها ارائه می کنند. جداسازی گلیکوزامینوگلیکان های دست نخورده در سلول ها با تجزیه آنها به قطعات تحت تأثیر اندو هگزوزامینیداز و اندوگلوکورونیداز آغاز می شود. الیگوساکاریدهای تشکیلشده در واکنشهای هیدرولیز در معرض اثرات متوالی اگزوگلیکوزیدازها و سولفاتازها قرار میگیرند که جدا میشوند.
مونومرها از انتهای غیر کاهنده بنابراین، هیدرولیز قطعات کندرویتین سولفات حاوی یک باقیمانده N-استیل گالاکتوزامین در انتهای غیر احیاکننده توسط سولفاتاز و سپس β-N-استیل گالاکتوزامینیداز و سپس (3-گلوکورونیداز. در نتیجه سولفات معدنی و مونوساکاریدها تشکیل می شود) آغاز می شود. (شکل 1.22).

برنج. 1.22.تجزیه کندرویتین سولفات
آنزیم ها: 1 - اندوگلیکوزیداز ; 2 - سولفاتاز؛ 3 - β - N-استیل گالاکتوز-
مینیداز 4 - β - گلوکورونیداز
هیالورونیداز در تجزیه اسید هیالورونیک به الیگوساکاریدها نقش دارد. هیدرولیز الیگوساکاریدهای حاصل توسط β-N-استیل گلوکوزامینیداز و β-D-گلوکورونیداز انجام می شود.
تجزیه خارج سلولی گلیکوزامینوگلیکان ها تنها مشخصه سولفات هپاران است که توسط هپاراناز شکافته شده و توسط پلاکت ها یا لنفوسیت های T سنتز می شود.
موکوپلی ساکاریدوزها
موکوپلی ساکاریدوزها - بیماری های ارثی شدید ناشی از نقص در هیدرولازهای دخیل در کاتابولیسم گلیکوزآمینوگلیکان ها. در لیزوزوم های بافت ها که با سنتز بیشترین مقدار گلیکوزامینوگلیکان ها مشخص می شود، گلیکوزامینوگلیکان های ناقص تخریب شده تجمع می یابند و قطعات الیگوساکارید آنها از طریق ادرار دفع می شود. انواع مختلفی از موکوپلی ساکاریدوزها وجود دارد که به دلیل نقص در آنزیم های مختلف دخیل در تجزیه گلیکوزآمینوگلیکان ها ایجاد می شوند.
موکوپلی ساکاریدوزها با اختلالات روانی در کودکان، ضایعات سیستم قلبی عروقی، بدشکلی های اسکلت استخوانی، به طور قابل توجهی در ناحیه فک و صورت، هیپوپلازی بافت های سخت دندانی، تیرگی قرنیه چشم و کاهش امید به زندگی ظاهر می شود. (جدول 1.3).
در حال حاضر، این بیماری ها قابل درمان نیستند، بنابراین، در صورت مشکوک شدن به حامل ژن های معیوب، باید تشخیص قبل از تولد انجام شود. در این موارد فعالیت هیدرولازهای لیزوزومی مشخص می شود.
1.4. پروتئین های غیر کلاژنی با خواص ویژه
پروتئین های چسبنده و ضد چسب
پروتئین های ماتریکس خارج سلولی وظایف مختلفی را انجام می دهند. برخی از آنها قابلیت چسباندن اجزای ماده و سلول های بین سلولی را دارند و این پروتئین ها نامیده می شوند. چسب. گروه دیگری از پروتئین ها، برعکس، مانع از چسبندگی سلول ها و اجزای خارج سلولی می شوند و به آنها می گویند. ضد چسب. تعامل سلول ها با ماتریکس خارج سلولی یک فرآیند پیچیده است و هم با افزایش چسبندگی و هم با تضعیف آن آشکار می شود. پروتئین های فیبرونکتین، ویترونکتین، لامینین، نیدوژن (انتاکتین) و اینتگرین در چسبندگی سلول های مزانشیمی و اپیتلیال نقش دارند. در مقابل، پروتئین های ضد چسب - تناسین، ترومبوسپوندین می توانند شکل سلول ها را تغییر دهند و تا حدی آنها را از اجزای ماتریکس خارج سلولی جدا کنند. در عین حال ، چنین تقسیم پروتئین ها به چسب و ضد چسب کاملاً مشروط است.
جدول 1.3بیماری های مرتبط با اختلال در متابولیسم گلیکوزامینوگلیکان ها

فیبرونکتین - گلیکوپروتئین با وزن مولکولی بالا، پروتئین کلیدی ماتریکس خارج سلولی که توسط فیبروبلاست ها سنتز می شود. بسته به قدرت یونی و pH ماتریکس خارج سلولی، شکل مولکول فیبرونکتین می تواند از کروی تا حد واسط متفاوت باشد. مولکول های فیبرونکتین دایمرهایی هستند که از دو زنجیره پلی پپتیدی مشابه که توسط فعل و انفعالات آبگریز و دو پیوند دی سولفید به هم مرتبط شده اند تشکیل شده اند. زیر واحدها به تعدادی حوزه مجزا تقسیم می شوند که قادر به اتصال به گیرنده های سلولی از طریق اینتگرین ها و همچنین کلاژن ها، فیبرین و پروتئوگلیکان ها هستند. مولکولهای فیبرونکتین که از طریق پلهای دی سولفیدی به یکدیگر متصل میشوند، ساختارهای فیبریلار را تشکیل میدهند (شکل 1.23).

برنج. 1.23.ساختار مولکول فیبرونکتین (آ).مدل مولکول فیبرونکتین (ب).اعداد نشان دهنده پیوند دامنه ها هستند: 1 - هپارین , 2 - سلول ها , 3 - کلاژن , 4 - سایر مولکول های فیبرونکتین [طبق گفته های Cooper G.M.، 2000، با تغییرات].
مولکول فیبرونکتین دارای محل اتصال برای آنزیم ترانس گلوتامیناز است. ترانس گلوتامیناز واکنش ترکیب باقی مانده های گلوتامین یک زنجیره پلی پپتیدی با باقی مانده های لیزین یک مولکول پروتئین دیگر را کاتالیز می کند. این امکان اتصال متقاطع مولکول های فیبرونکتین را با یکدیگر، کلاژن و سایر پروتئین ها توسط پیوندهای کووالانسی عرضی فراهم می کند. فیبرونکتین در فرآیندهای سلولی متعددی از جمله ترمیم بافت، جنین زایی، مهاجرت و چسبندگی سلولی نقش دارد.
اینتگرین ها پروتئین های هترودیمری با مول هستند. با وزن 100-160 کیلو دالتون، واقع بر روی غشای پلاسمایی سلول ها و متشکل از دو زیرواحد a- و (3 زیرواحد) غیرکووالانسی متصل شده است. برای عملکرد اینتگرین ها، وجود یون های دو ظرفیتی (Ca2+ یا Mg2+) ضروری است، زیرا اتصال کاتیون های Ca2+ به بخش های N ترمینال اجازه می دهد α- و (3 زیرواحد برای اتصال به یکدیگر و اتصال به ماتریکس خارج سلولی. آنها قادر به تشخیص پپتید RGD در پروتئین های ماتریکس هستند. arg-gli-asp).
خانواده اینتگرین ها شامل 20 نوع گیرنده با ویژگی های مختلف است. این تنوع با تفاوت در ساختار ایجاد می شود α- و (3 زنجیره. 9 نوع زنجیره α و 14 (3 زیرواحد) شرح داده شده است. هر زنجیره اینتگرین یک بار از غشاء عبور می کند. هر دو زنجیره اینتگرین دارای حوزه های خارج سلولی بزرگی هستند. این حوزه ها چسبندگی سلولی را به سلول ها و اجزای تشکیل می دهند. ماتریکس خارج سلولی - کلاژن، فیبرونکتین، ویترونکتین، لامینین (شکل 1.24).
اینتگرین ها به دلیل جهت غشایی خود سیگنال هایی را از ماتریکس خارج سلولی به اسکلت سلولی حمل می کنند.اکثر اینتگرین ها با نواحی C ترمینال سیتوپلاسمی با پروتئین های اتصال دهنده اکتین سلول ها مرتبط هستند. هنگام اتصال لیگاند، زیرواحدهای β از اینتگرین های اتصال با پروتئین های به اصطلاح تعامل دارند.

برنج. 1.24.برهمکنش اینتگرین ها با پروتئین های اکتین اسکلت سلولی و ماتریکس خارج سلولی [طبق گفته Campbell N. A.، Reece J. B.، 2002، با تغییرات].
اتصال کامی - تالین و α-اکتینین، که به نوبه خود، شروع به مونتاژ سایر پروتئین های اتصال می کنند. بنابراین، اینتگرین ها به رشته های اکتین متصل می شوند. رشته های اکتین از طریق اینتگرین ها می توانند جهت گیری مولکول های فیبرونکتین ترشح شده را در ماتریکس خارج سلولی تغییر دهند. در عین حال، ماتریکس خارج سلولی می تواند بر سازماندهی اسکلت سلولی در سلول های هدف تأثیر بگذارد که انتقال سیگنال دو طرفه را تضمین می کند. اتصال اینتگرین ها به لیگاندها و همگرایی سلول ها برای بازآرایی غشای پایه ضروری است.
برهمکنش اینتگرین ها با پروتئین های ماتریکس خارج سلولی در برخی موارد از آپوپتوز جلوگیری می کند. از دست دادن برخی از اینتگرین ها (در سرطان سینه، پروستات، روده بزرگ) یا بیش از حد آنها (در ملانوم، کارسینوم سلول سنگفرشی حفره دهان، نازوفارنکس، حنجره) با درجه بالایی از بدخیمی تومور همراه است.
بنابراین، اطلاعاتی که اینتگرین ها از ماتریکس خارج سلولی به داخل سلول منتقل می کنند، در برخی موارد چسبندگی و مهاجرت سلول های تومور را تحریک می کند و در موارد دیگر منجر به مرگ آنها می شود. به عبارت دیگر، اینتگرین ها نقش نوعی "سوئیچ" را بازی می کنند که سرنوشت بیشتر سلول تومور را تعیین می کند.
لامینین ها - نمایندگان خانواده گلیکوپروتئین های چسبنده c mol. وزن 850 کیلو دالتون مولکول لامینین یک مجتمع انعطاف پذیر بزرگ است که از طول تشکیل شده است α-, زنجیره های پلی پپتیدی β 1 -، β 2 - به شکل یک صلیب نامتقارن مرتبط هستند و توسط پیوندهای دی سولفید در کنار هم نگه داشته می شوند. هر زنجیره حاوی چندین حوزه عملکردی است که قادر به اتصال به کلاژن نوع IV، سولفات هپاران، انتاکتین (نیدوژن) و گیرنده های سطح سلولی است. لامینین ها سلول های اپیتلیال را به غشای پایه می چسبانند (شکل 1.25).
در مراحل اولیه مورفوژنز، غشای پایه عمدتاً از یک شبکه لامینین تشکیل شده است و حاوی کلاژن نوع IV (یا حاوی مقدار کمی) است.
لامینین ها در غشای پایه با پروتئین نیدوژن کمپلکس هستند که توسط دامنه C ترمینال به (3 2 زنجیره لامینین) متصل است. ناحیه N ترمینال نیدوژن شامل دو حوزه کروی است که یکی از آنها به نوع متصل می شود. کلاژن IV و پروتئین هسته پروتئوگلیکان پرلکان، بنابراین، لامینین، همراه با نیدوژن، سازماندهی ساختاری اجزای غشای پایه را فراهم می کند.
برنج. 1.25.ساختار لامینین [با توجه به کوپر G.M.، 2000، با تغییرات].

لامینین ها مهاجرت سلول های اپیتلیال را تضمین می کنند و بنابراین در ادنتوژنز، اتصال بافت های پریودنتال به سیمان ریشه دندان، ساخت غشای اپیتلیال روی سطح بافت پالپ در طول تشکیل پولیپ پالپ شرکت می کنند.
ویترونکتین - گلیکوپروتئین موجود در پلاسمای خون و ماتریکس خارج سلولی. ویترونکتین با گلیکوزآمینوگلیکان ها، کلاژن، پلاسمینوژن، گیرنده یوروکیناز تعامل دارد. با تثبیت ترکیب مهاری بازدارنده فعال سازی پلاسمینوژن 1 (پروتئیناز)، تخریب ماتریکس را تنظیم می کند. از طریق اتصال ویترونکتین به کمپلمان، هپارین و کمپلکس های ترومبین-آنتی ترومبین III، در پاسخ ایمنی و تنظیم انعقاد خون نقش دارد. زنجیره پلی پپتیدی ویترونکتین حاوی توالی اسید آمینه RGD است که تعامل آن را با α V β گیرنده 3 اینتگرین و مشارکت در اتصال، گسترش و حرکت سلول ها.
تناسین و ترومبوسپوندین - گلیکوپروتئین هایی که هم خاصیت چسبندگی و هم خاصیت ضد چسبندگی دارند. تناسین و ترومبوسپوندین نقش خاصی در جنین زایی و ریخت زایی دارند. این پروتئین ها تحت شرایط تغییر شکل سلول را ایجاد می کنند درونکشتگاهی،که به نوبه خود منجر به تغییر در رفتار سلول ها در کشت می شود. آنها با تغییر تماس های چسبنده با فاکتورهای پروتئینی که تحرک سلولی را فراهم می کنند، به سازماندهی مجدد اسکلت سلولی اکتین کمک می کنند. تناسین و ترومبوسپوندین با پروتئوگلیکان ها کمپلکس تشکیل می دهند و هنگامی که تناسین به کندرویتین سولفات متصل می شود، خواص چسبندگی پروتئوگلیکان ها تغییر می کند.
تناسین - گلیکوپروتئین الیگومریک با یک مول. با وزن بیش از 100 کیلو دالتون مولکول این پروتئین ساختار موزاییکی دارد و توالی اسید آمینه آن مشابه فاکتور رشد اپیدرمی است. تناسین حاوی دامنه های متصل شونده به کلسیم است.
ترومبوسپوندین - یک گلیکوپروتئین که خاصیت ضد چسبندگی خود را در سلولهای اندوتلیال و فیبروبلاستها نشان میدهد، زیرا با (3-تبدیلکننده و فاکتورهای رشد پلاکتی، اتصال مولکولهای ماتریکس به یکدیگر را ضعیف میکنند.
ترومبوسپوندین همچنین در هنگام تعامل با مولکول های اینتگرین، گلیکوپروتئین، سولفات هپاران و همچنین خاصیت چسبندگی نشان می دهد.
گلیکولیپیدها حوزه های کروی موجود در نواحی ترمینال N و C باعث اتصال کلسیم به هپارین می شوند و پس از آن ترومبوسپوندین با کلاژن، فیبرونکتین، فیبرینوژن، لامینین و پلاسمینوژن تعامل می کند.
علاوه بر پروتئین های چسبنده که در سازماندهی مجتمع های فوق مولکولی ماتریکس بین سلولی نقش دارند، بافت ها حاوی گلیکوپروتئین های مربوط به فاکتورهای رشد هستند.
عوامل رشد
فاکتورهای رشد معمولاً پلی پپتیدهای کوچکی هستند که تکثیر انواع خاصی از سلول ها را تحریک یا مهار می کنند. به عنوان یک قاعده، آنها توسط یک سلول ترشح می شوند و روی سلول های دیگر عمل می کنند، اگرچه گاهی اوقات اتفاق می افتد که روی همان سلول هایی که آنها را ترشح می کنند، عمل می کنند. فاکتورهای رشد به گیرنده های خاص خود که در سطح غشای سلولی سلول های هدف آنها قرار دارند متصل می شوند. اکثر فاکتورهای رشد پروتئین کینازهای تیروزین را در سلولها فعال می کنند و تنها TGF-(3) پروتئین کینازهای ترئونین را فعال می کند.
عامل رشد تبدیل کننده (TFR-(3) - خانواده ای از گلیکوپروتئین ها شامل 6 پروتئین مختلف. آنها دایمرهایی هستند که از دو زیر واحد یکسان تشکیل شده اند. پروتئین های TGF-(3) به عنوان پیش سازها سنتز می شوند، به شکل غیر فعال ترشح می شوند و با پروتئولیز محدود فعال می شوند.
سه نوع گیرنده TGF بر روی غشای سلولی سلول های بلاست شناسایی شد. گیرنده های نوع سوم پروتئوگلیکان های سطحی هستند و دسترسی TGF-(3) به گیرنده های نوع اول و دوم را فراهم می کنند که پس از اتصال به TGF-(3)، یک هترودایمر با فعالیت پروتئین کیناز تشکیل می دهند.دامنه سیتوپلاسمی گیرنده ها در باقیماندههای سرین و ترئونین اتوفسفریله میشود. سپس پروتئینهای سیتوپلاسمی فسفریله میشوند و در انتقال سیگنال به هسته، جایی که ژن رونویسی فعال میشود، نقش دارند. از طریق این مکانیسم، سنتز پروتئینهای ماتریکس خارج سلولی مانند کلاژن نوع I و متالوپروتئینازها است. فعال شد.
علاوه بر این، TGF-(3) به عنوان یک عامل کموتاکسی برای مونوسیت ها و فیبروبلاست ها عمل می کند و از تکثیر و عملکرد لنفوسیت های T و B و سلول های اندوتلیال جلوگیری می کند. در میان شبکه پیچیده سیتوکین ها که بر عملکرد ادنتوبلاست ها در فرآیند تأثیر می گذارد. در بازسازی عاج، TGF نقش مهمی ایفا می کند -(3، که عمل می کند
این ماده به عنوان یک سرکوب کننده ایمنی قوی و القا کننده سنتز پروتئین ماتریکس خارج سلولی عمل می کند. TFR- β در طول التهاب، هموستاز را در مجموعه عاج- پالپ حفظ می کند.
پروتئین مورفوژنتیک استخوان (MBK) -یک گلیکوفسفوپروتئین اسیدی غنی از سرین و گلیسین حاوی سه پیوند دی سولفید. بازیابی پیوندهای دی سولفیدی باعث غیرفعال شدن MBC می شود. در پالپ دندان در پاسخ به محرک های خارجی توسط ادونتوبلاست ها ترشح می شود تا عاج جایگزین را تشکیل دهد. MBC در بافت استخوانی بسیار فعال است و باعث تمایز سلول های بنیادی به سلول های استخوانی می شود.
فاکتور رشد اندوتلیال (رایگان) -یک گلیکوپروتئین که فقط به سلول های اندوتلیال عروقی متصل می شود و تکثیر آنها را تحریک می کند.
علاوه بر این، EGF می تواند یک پروتئین خاص، از جمله یک کمپلکس کیناز را فعال کند. پروتئین های فسفریله به دست آمده باعث حرکت سلولی می شوند، بنابراین هنگامی که پالپ دندان، بافت استخوان، غشای مخاطی، پریودنتیوم و سایر بافت های حفره دهان تحت تأثیر EGF آسیب می بینند، سلول ها به سرعت حرکت می کنند، افزایش می یابند و با فعال شدن آلکالین فسفاتاز تمایز پیدا می کنند. .
EGF باعث اتساع عروق می شود که یک شرط مهم برای حفظ جریان خون در بافت ها در طول التهاب است. همچنین سنتز IL-1، فاکتور نکروز تومور (TNF) را افزایش می دهد، که به طور قابل توجهی به اتساع عروق در فرآیندهای پاتولوژیک کمک می کند. اختلال در فرآیندهای فاکتورهای رشد اندوتلیال با افزایش فشار اسمزی، درد و تغییرات غیرقابل برگشت در بافت همراه است.
فاکتور رشد شبه انسولین (FMI)اثرات اتوکرین و پاراکرین دارد. مشارکت آن در رشد سریع سلول ها، تمایز آنها و معدنی شدن بافت های سخت دندان فرض می شود.
فاکتور رشد فیبروبلاست (FRF) -خانواده ای از پلی پپتیدهای مرتبط با ساختار، که توسط 9 پروتئین نشان داده شده است. مول. جرم اشکال مختلف FGF از 168 تا 250 کیلو دالتون متغیر است. تا 50 درصد از توالی اسید آمینه مولکول فاکتور رشد فیبروبلاست با ساختار فاکتور رشد اندوتلیال مطابقت دارد. هر دوی این پپتیدها نیز تمایل مشابهی به هپارین نشان می دهند و باعث اتساع عروق می شوند. فاکتور رشد فیبروبلاست در رشد و تمایز فیبروبلاست ها در طول تشکیل یک کپسول فیبری در اطراف کانون التهابی نقش دارد.
فاکتور رشد عصبی (FRN) -خانواده ای از پروتئین ها که رشد سلول های بافت عصبی را تحریک می کنند. تقریبا تمام سلول های انسان این عامل را سنتز می کنند. فاکتور رشد عصب به دلیل رشد آکسون ها از تنه عصبی آسیب دیده یا رشته های عصبی دست نخورده مجاور در بهبود سریع ناحیه آسیب دیده نقش دارد. بنابراین، NGF ممکن است نقش مهمی در پاسخ سلول های عصبی به آسیب داشته باشد. آزاد شدن NGF به داخل حفره دهان با بزاق باعث بهبود نواحی آسیب دیده غشای مخاطی می شود.
فاکتور رشد هپاتوسیت (آلمان)تکثیر سلولی در بافت های مختلف را تحریک می کند. ممکن است در تجمع سلولی در صورت آسیب بافتی و همچنین در مورفوژنز بافت های دندان نقش داشته باشد.
فاکتور رشد اپیدرمی (EFR) -پروتئین با مول با وزن 70 کیلو دالتون تمیز دادن α - و بتا فرم EGF. این بر سلول های اکتودرم تأثیر می گذارد: کراتینوسیت های پوست، اپیتلیوسیت های غشای مخاطی حفره دهان، مری، حلق و همچنین مزودرم: کندروسیت ها، اندوتلیوم عروقی. فاکتور رشد اپیدرمی تمایز ادونتوبلاست ها را تحریک می کند و سنتز DNA را در آنها در زمان بلوغ بافت های دندانی افزایش می دهد. با افزایش سن، EGF از تقسیم ادونتوبلاست ها جلوگیری می کند، سنتز کلاژن نوع I را کاهش می دهد و فعالیت آلکالین فسفاتاز را کاهش می دهد. تولید EGF تحت تاثیر هورمون های استروئیدی، تیروکسین و پروژسترون است.
فاکتور رشد پلاکتی (FRT)سلول های زیادی را تحت تاثیر قرار می دهد. سنتز آلکالین فسفاتاز و پروتئوگلیکان ها را در سلول های ادونتوبلاست پالپ دندان و بافت استخوانی القا می کند.
1.5. کاتابولیسم پروتئین در ماتریکس بین سلولی
بازسازی بافت با تمایز و مهاجرت سلولی همراه است. سلولی که وارد مسیر تمایز شده است ناگزیر می میرد. سلول جدید در حال ظهور شروع به سنتز پروتئین های جدید خود می کند که برخی از آنها وارد ماتریکس می شوند.
در کاتابولیسم پروتئین های سلولی و ماتریکس خارج سلولی، نقش اصلی به متالوپروتئینازهای ماتریکس (MMPs، matricins) اختصاص دارد. تحت شرایط فیزیولوژیکی، MMPها نقش اصلی را در فرآیندهای مورفوژنز، بازسازی و تحلیل بافت ایفا می کنند. ماتریکسین ها عمل خود را در ماتریکس بین سلولی نشان می دهند. مرکز فعال این آنزیم ها حاوی کلسیم یا روی است، بنابراین به آنها متالوپروتئینازهای ماتریکس روی وابسته به Ca 2+ می گویند. بیشتر شناخته شده است
20 متالوپروتئیناز مختلف که از نظر ویژگی سوبسترا و سایر خواص متفاوت هستند. بر اساس سازماندهی ساختاری و ویژگی بستر، چهار زیر خانواده اصلی MMPها شناسایی شده است:
کلاژنازها -شروع هیدرولیز ناحیه مارپیچ کلاژن نوع I، II و III.
ژلاتیناز -غشاهای پایه کلاژن نوع IV را هیدرولیز کنید.
استروملیزین -شکاف پروتئین های هسته پروتئوگلیکان ها و تعدادی از پروتئین های ماتریکس چسب.
متالولاستاز - الاستین را می شکند
کلاژنازهای مربوط به MMP-1 و MMP-13 در تجزیه کلاژن بومی نقش دارند که نیمه عمر آن در هفته یا ماه اندازه گیری می شود. کلاژنازها هر سه پپتید را قطع می کنند α - زنجیرهای یک مولکول کلاژن بومی در یک ناحیه مارپیچ، تقریباً 1/4 فاصله از انتهای C، بین باقی ماندههای گلیسین و لوسین (یا ایزولوسین). قطعات کلاژن حاصل در آب محلول می شوند و دناتوره می شوند و پس از آن پیوندهای پپتیدی آنها برای هیدرولیز توسط پپتیدازهای دیگر در دسترس می شود.
هیدرولیز کلاژن های غشای پایه با مشارکت ژلاتینازها (MMP-2، MMP-9) اتفاق می افتد. اتصال ژلاتین ها و کلاژن ها توسط ژلاتینازها شامل حوزه موسوم به فیبرونکتین است که در ساختار ناحیه N ترمینال آنزیم وجود دارد.
دو آنزیم دیگر - stromelysin -1 (MMP-3) و stromelysin - 2 (MMP-10)، پروتئین های هسته پروتئوگلیکان ها و تعدادی از پروتئین های چسبنده ماتریکس خارج سلولی را می شکافند (جدول 1.4).
فعالیت متالوپروتئینازهای ماتریکس با تخریب ماتریکس بین سلولی افزایش می یابد، که در تعدادی از بیماری ها - پریودنتیت، پالپیت، زخم های مزمن، تهاجم و متاستاز تومورها و غیره مشاهده می شود.
تنظیم فعالیت متالوپروتئینازهای ماتریکس
فعالیت متالوپروتئینازهای ماتریکس تحت کنترل دائمی است.
اولا،آنها به عنوان پیش آنزیم سنتز می شوند. پپتید سیگنال، ترشح مستقیم مولکول را فراهم می کند و پس از جدا شدن آن، یک پروآنزیم تشکیل می شود. پروآنزیم حاوی یک توالی اسید آمینه است که در آن باقیمانده سیستئین به مولکول Zn 2+ واقع در مرکز فعال متصل می شود. متعاقباً، پس از برش پلی پپتید، شکل فعال تشکیل شده MMP شامل دو حوزه اصلی است. دامنه N ترمینال حاوی روی متصل است
نوع MMP | آنزیم | مول. وزن، کیلو دالتون | تقسیم اجزا |
MMP-1 | کلاژناز درونی | کلاژن I، II، III، VII، VIII، X انواع، ژلاتین، پروتئوگلیکان ها |
|
MMP-2 | ژلاتیناز A | انواع ژلاتین، کلاژن IV، V، VII، X، XI، فیبرونکتین، الاستین، پروتئوگلیکان ها |
|
MMP-9 | ژلاتیناز B | ژلاتین، کلاژن IV، انواع V، الاستین، پروتئوگلیکان ها |
|
MMP-3 | استروملیزین-1 | الاستین، پروتئوگلیکان، لامینین، فیبرونکتین، کلاژن نوع IV، VII، IX، پرو MMP-1 |
|
MMP-7 | ماتریلیسین | پروتئوگلیکان، لامینین، ژلاتین، فیبرونکتین، کلاژن نوع IV، proMMP-1، -7، -8، -9 |
|
MMP-12 | فلز لو الاستاز | الاستین |
|
MMP-13 | کلاژناز درونی-3 | انواع کلاژن I، II، III، ژلاتین |
|
MMP-14 | نوع غشاء MMP | انواع کلاژن I، II، III، proMMP- 2، -13 (نوع غشایی) |
یک محل اتصال که در آن روی ۲+ توسط سه باقی مانده هیستیدین محدود شده و دارای فعالیت کاتالیزوری است. در کاتالیز علاوه بر روی، باقیمانده اسید گلوتامیک نیز نقش دارد. دامنه C ترمینال مسئول اتصال به بسترها و مهارکننده های MMP است. بین دامنه های ترمینال N و C یک دامنه اتصال کوچک وجود دارد که ویژگی بستر را فراهم می کند (شکل 1.26، A).
پروتئینازهای مختلف در برش پپتید سیگنال نقش دارند. بنابراین، پلاسمین پروتئیناز شبه تریپسین، متالوپروتئیناز غشایی proMMP-2، ژلاتیناز A proMMP-9 در واکنش فعال سازی آنزیم های فعال proMMP-1 و proMMP-3 شرکت می کنند (شکل 1.26، B).


برنج. 1.26.ساختار proMMP-1: آ -فعال شدن آنزیم پس از برش پروپپتید سیگنال رخ می دهد. ب -پروتئینازهای مختلف در پروتئولیز محدود proMMPها نقش دارند.
دوما، فعالیت آنزیم ها به میزان بیان ژن های آنها بستگی دارد. بیشتر MMP ها به عنوان آنزیم های "القایی" نامیده می شوند که سنتز آنها در سطح رونویسی توسط کنترل می شود.
عوامل: سیتوکین ها و سایر عوامل موثر بر روی سطح سلول (استروژن، پروژسترون و غیره). پروموترهای MMP حاوی عناصر مشترکی هستند که مسئول تنظیم بیان ژن هستند.
ثالثادر شرایط فیزیولوژیکی، بافت ها حاوی مقدار ناچیزی از MMP ها هستند و فعالیت آن ها به وجود فعال کننده ها و بازدارنده ها در محیط بستگی دارد. فعالیت MMP تحت کنترل پروتئین های خاص - مهارکننده های بافتی متالوپروتئینازها (TIMPs) است. در حال حاضر، چهار نوع TIMP جدا شده از بافت های مختلف انسانی به خوبی مورد مطالعه قرار گرفته است: TIMP-1، TIMP-2، TIMP-3، TIMP-4. TIMP ها می توانند به هر دو شکل فعال و غیر فعال MMP متصل شوند. این پروتئین ها در اثر خاص خود بر روی متالوپروتئینازها متفاوت هستند. بنابراین، TIMP-1 MMP-9 را خیلی بهتر مهار می کند، در حالی که TIMP-2 فعالیت MMP-2 را سرکوب می کند. TIMP ها با هیدرولیز با مشارکت پروتئینازهای مختلف - تریپسین، کیموتریپسین، استروملیزین-3 و نوتروفیل الاستاز غیرفعال می شوند.
ماتریکس بین سلولییک کمپلکس فوق مولکولی است که توسط شبکه پیچیده ای از ماکرومولکول های به هم پیوسته تشکیل شده است.
در بدن، ماتریکس خارج سلولی ساختارهای بسیار تخصصی مانند غضروف، تاندون ها، غشاهای پایه و (با رسوب ثانویه فسفات کلسیم) استخوان ها و دندان ها را تشکیل می دهد. این ساختارها هم در ترکیب مولکولی و هم در نحوه سازماندهی اجزای اصلی (پروتئین ها و پلی ساکاریدها) در اشکال مختلف ماتریکس خارج سلولی با یکدیگر متفاوت هستند.
ترکیب شیمیایی ماتریکس بین سلولی
ترکیب ماتریکس بین سلولی شامل: 1). کلاژن و الیاف الاستین . آنها به پارچه استحکام مکانیکی می دهند و از کشش آن جلوگیری می کنند. 2). ماده بی شکل به شکل GAG ها و پروتئوگلیکان ها. آب و مواد معدنی را حفظ می کند، از فشرده شدن بافت جلوگیری می کند. 3). پروتئین های ساختاری غیر کلاژنی - فیبرونکتین، لامینین، تناسین، استئونکتین و غیره. علاوه بر این، ماتریکس خارج سلولی ممکن است حاوی جزء معدنی - در استخوان ها و دندان ها: هیدروکسی آپاتیت، کلسیم، فسفات های منیزیم و غیره. به استخوان ها، دندان ها استحکام مکانیکی می دهد، ذخیره ای از کلسیم، منیزیم، سدیم، فسفر در بدن ایجاد می کند.
عملکرد ماتریکس خارج سلولی
ماتریکس بین سلولی وظایف مختلفی را در بدن انجام می دهد:
چارچوب اندام ها و بافت ها را تشکیل می دهد.
این یک چسب "بیولوژیکی" جهانی است.
در تنظیم متابولیسم آب نمک شرکت می کند.
ساختارهای بسیار تخصصی (استخوان ها، دندان ها، غضروف ها، تاندون ها، غشای پایه) را تشکیل می دهد.
سلول های اطراف بر چسبندگی، رشد، تکثیر، سازماندهی و متابولیسم آنها تأثیر می گذارد.
کلاژن
کلاژن- پروتئین فیبریلار، جزء ساختاری اصلی ماتریکس خارج سلولی. کلاژن استحکام فوق العاده ای دارد (کلاژن از سیم فولادی با سطح مقطع یکسان قوی تر است، می تواند باری 10000 برابر وزن خود را تحمل کند) و عملا غیر قابل امتداد است. این فراوان ترین پروتئین در بدن است که 25 تا 33 درصد از کل پروتئین بدن را تشکیل می دهد. 6 درصد وزن بدن حدود 50 درصد از کل پروتئین های کلاژن در بافت های اسکلتی، حدود 40 درصد در پوست و 10 درصد در استرومای اندام های داخلی یافت می شود.
ساختار کلاژن
کلاژن به دو ماده اشاره دارد: تروپوکلاژن و پروکلاژن.
مولکول تروپوکلاژن از 3 زنجیره α تشکیل شده است. حدود 30 نوع زنجیره α شناخته شده است که در ترکیب اسید آمینه با یکدیگر متفاوت هستند. بیشتر زنجیره های α حاوی حدود 1000AA هستند. تروپوکلاژن حاوی 33 درصد گلیسین، 25 درصد پرولین و 4 هیدروکسی پرولین، 11 درصد آلانین، هیدروکسی لیزین، هیستیدین کمی، متیونین و تیروزین، بدون سیستئین و تریپتوفان است.
ساختار اولیه زنجیره های α از یک توالی اسید آمینه تکرار شونده تشکیل شده است: گلایسین-X-Y . V ایکسموقعیت اغلب پرولین است و در Y- 4-هیدروکسی پرولین یا 5-هیدروکسی لیزین.
· ساختار فضایی زنجیره α با یک مارپیچ چپ نشان داده می شود که در سیم پیچ آن 3 AA وجود دارد.
3 زنجیره α در یک سوپرمارپیچ راست دست با یکدیگر پیچیده شده اند تروپوکلاژن . با پیوندهای هیدروژنی تثبیت می شود، رادیکال های AA به سمت بیرون هدایت می شوند.
مولکول پروکلاژن به همان روش تروپوکلاژن مرتب شده است، اما در انتهای آن قرار دارد پروپپتیدهای C و N، تشکیل گلبول ها پروپپتید N ترمینال از 100AA تشکیل شده است، پروپپتید ترمینال C از 250AA تشکیل شده است. پروتئوپپتیدهای C و N حاوی سیستئین هستند که یک ساختار کروی را از طریق پل های دی سولفیدی تشکیل می دهد.
انواع کلاژن
کلاژن یک پروتئین چند شکل است، در حال حاضر 19 نوع کلاژن شناخته شده است که در ساختار اولیه زنجیره های پپتیدی، عملکردها و محلی سازی در بدن با یکدیگر متفاوت هستند. 95 درصد از کل کلاژن بدن انسان را کلاژن نوع I، II و III تشکیل می دهد.
| انواع | ژن ها | بافت ها و اندام ها |
| من | COLIA1، COL1A2 | پوست، تاندون ها، استخوان ها، قرنیه، جفت، شریان ها، کبد، عاج |
| II | COL2A1 | غضروف، دیسک های بین مهره ای، بدن زجاجیه، قرنیه |
| III | C0L3A1 | شریان ها، رحم، پوست جنین، استرومای اندام های پارانشیمی |
| IV | COL4A1-COL4A6 | غشاهای پایه |
| V | COL5A1-COL5A3 | جزء جزئی بافت های حاوی کلاژن نوع I و II (پوست، قرنیه، استخوان، غضروف، دیسک های بین مهره ای، جفت) |
| VI | COL6A1-COL6A3 | غضروف، رگ های خونی، رباط ها، پوست، رحم، ریه ها، کلیه ها |
| VII | COL7A1 | آمنیون، پوست، مری، قرنیه، کوریون |
| هشتم | COL8A1-COL8A2 | قرنیه، عروق خونی، محیط کشت اندوتلیال |
| IX | COL9A1-COL9A3 | |
| ایکس | COL10A1 | غضروف (هیپرتروفی) |
| XI | COLUA1-COL11A2 | بافت های حاوی کلاژن نوع II (غضروف، دیسک های بین مهره ای، بدن زجاجیه) |
| XII | COL12A1 | |
| سیزدهم | C0L13A1 | بسیاری از پارچه ها |
| چهاردهم | COL14A1 | بافت های حاوی کلاژن نوع I (پوست، استخوان، تاندون و غیره) |
| XV | C0L15A1 | بسیاری از پارچه ها |
| شانزدهم | COL16A1 | بسیاری از پارچه ها |
| XVII | COL17A1 | همیدزموزوم های پوستی |
| هجدهم | COL18A1 | بسیاری از بافت ها، به عنوان مثال کبد، کلیه ها |
| نوزدهم | COL19A1 | سلول های رابدومیوسارکوم |
نام ژن های کلاژن بر اساس انواع کلاژن است و با اعداد عربی نوشته می شود، به عنوان مثال، COL1 ژن کلاژن نوع 1، COL2 ژن کلاژن نوع II و غیره است. حرف A (نشان دهنده زنجیره α) و یک عدد عربی (نشان دهنده نوع زنجیره α) به این نماد اختصاص داده شده است. به عنوان مثال، COL1A1 و COL1A2 به ترتیب برای زنجیره α 1 و α 2 کلاژن نوع I کد می کنند.