مشکل کنترل ژنتیکی امید به زندگی و روند پیری جنبه های زیادی دارد که یکی از آنها در مطالعه بیماری های ارثی در گروه لامینوپاتی ها برجسته شد. لامینوپاتی ها گروهی از بیماری های ارثی هستند که در اثر جهش در ژن های کد کننده پروتئین لایه های هسته ای ایجاد می شوند که بخشی از پوسته هسته سلول است و نقش مهمی در حفظ سفتی آن ایفا می کند.
پوشش هسته ای شامل یک غشای هسته ای دو لایه، متشکل از لایه های بیرونی و داخلی، مجموعه ای از منافذ هسته ای و یک لایه هسته ای است که در زیر سطح غشای هسته ای داخلی قرار دارد. در ابتدا، لامینا به عنوان یک جزء فیبری هسته، متشکل از رشته هایی با اندازه رشته های میانی (10-13 نانومتر) یافت شد [رشته های میانی (IF) عناصری از ساختارهای اسکلت سلولی موجودات چند سلولی هستند و هر دو در سیتوپلاسم یافت می شوند. و در هسته]. ویژگی های ساختاری رشته های لامینا توسط پروتئین هایی که آنها را تشکیل می دهند، به نام لامین تعیین می شود.
لامین ها به ابرخانواده پروتئین IF، گروه 5 تعلق دارند (4 گروه باقیمانده سیتوپلاسمی هستند) و به دلیل ویژگی های ساختاری خود، قادر به تغییر پس از ترجمه هستند. تعداد پروتئین های لامین موجود در متازوئن های مختلف متفاوت است. انسان ها (و سایر پستانداران) دارای 3 ژن هستند که 7 پروتئین مختلف را کد می کنند. این پروتئین ها به دو نوع تقسیم می شوند - نوع A و نوع B، که از نظر کنترل ژنتیکی، روش سنتز، الگوی بیان و سایر ویژگی ها متفاوت هستند (جدول 1 - طبق نظر C.J. Hutchison، 2002 با تغییرات).
|
نوع لامین |
اصطلاح |
|||
|
A، AD10 *، C |
LMNA |
پیوند جایگزین |
سلول های تمایز یافته |
|
|
LMNA |
پیوند جایگزین |
ژرملاین (بیان خاص اسپرم) |
||
|
LMNB 1 |
محصول ژن LMNB 1 |
اکثر سلول ها |
||
|
LMNB2 |
پیوند جایگزین |
اکثر سلول ها |
||
|
LMNB2 |
پیوند جایگزین |
فقط در اسپرماتوسیت ها |
* - این لامین در برخی از رده های سلولی تومور نیز یافت شد.
[پیشگیری جایگزین، «تغییر شکل» کنترلشده مولکولهای RNA پیامرسان (mRNA) است که از یک ژن خوانده میشود، همراه با پیوستن اگزونهای ژن در ترکیبهای مختلف با تشکیل مولکولهای مختلف mRNA بالغ، این تضمین میکند که یک ژن محصولات نهایی مختلف را کد میکند. یکی از مکانیسم های اصلی برای ایجاد تنوع پروتئین در یوکاریوت های بالاتر است.]
لامین های B1 و B2 در اکثر سلول ها در جنین و بالغ بیان می شوند. یکپارچگی هسته، بقای سلول و رشد طبیعی به آنها بستگی دارد. لامین های نوع A الگوی بیان متفاوتی دارند که با تمایز سلولی مرتبط است. این به این پیشنهاد منجر شد که لامین های نوع B میزان زنده ماندن ارگانیسم را تعیین می کنند، در حالی که لامین های نوع A عملکردهای تخصصی تری دارند. شواهدی مبنی بر دخالت لامین ها در رونویسی و پردازش پس از رونویسی RNA وجود دارد.
در دهه گذشته، جهش در LMNA با تعدادی از بیماری های بالینی متنوع همراه بوده است که در گروهی از لامینوپاتی ها دسته بندی می شوند. تشدید تحقیقات در این جهت منجر به افزایش قابل توجهی از انتشارات شد: تنها در سال 2005 تعداد آنها از 200 فراتر رفت. در لامینوپاتی ها، اختلالاتی مشاهده می شود که منجر به تغییر در ساختار ماهیچه های مخطط و چاقی، پلی نوروپاتی، لیپودیستروفی، کاردیومیوپاتی، کمک به ایجاد مقاومت به انسولین، اختلالات پوستی و غیره.
اما چشمگیرترین فنوتیپ ناشی از جهش در LMNA و اختلال پیرایش متعاقب آن، پروگریا یا سندرم پیری زودرس - سندرم هاچینسون-گیلفورد است. وجود لامین معیوب در هسته سلول منجر به تغییرات پاتولوژیک بسیاری می شود: محتوای تعدادی از پروتئین ها در هسته به شدت کاهش می یابد، پوشش هسته کوچک می شود و روند ترمیم خطاهایی که در طول سنتز DNA رخ می دهد مختل می شود. در نتیجه سلول ها توانایی تقسیم شدن خود را از دست می دهند، سلول های مرده با سلول های جدید جایگزین نمی شوند که منجر به پیری زودرس بدن می شود. این بیماران تا 20 سال عمر نمی کنند و در 10-12 سالگی شبیه افراد پیر کوچک باستانی به نظر می رسند.
یک رونق واقعی پیام پی. اسکافیدی و تی میستلی در مجله ساینس (2006) بود که نشان داد ژن LMNA مستقیماً نه تنها با ایجاد سندرم پروگریا، بلکه با روند "طبیعی" مرتبط است. تسریع نشده - پیری فیزیولوژیکی. دانشمندان دریافته اند که اتصال اشتباه RNA پیام رسان لامین نه تنها در بیماران مبتلا به پروگریا، بلکه در افراد سالم نیز اتفاق می افتد، اما با فرکانس بسیار کمتری. اگرچه مقدار لامین معیوب با افزایش سن افزایش نمی یابد، اما با گذشت زمان (در افراد مسن) تغییراتی در سلول ها مشابه تغییرات در بیماران مبتلا به پروگریا مشاهده می شود. در آزمایشی بر روی فیبروبلاستهای گرفته شده از افراد مسن، نشان داده شد که سرکوب پیوند نادرست منجر به جوانسازی سلولها میشود.
در یک مطالعه تجربی حیوانی که توسط گروهی از دانشمندان از ایالات متحده آمریکا و سوئد به رهبری L.G. فونگ نشان داده شد که برای عملکرد طبیعی پوسته های هسته و جلوگیری از پیری زودرس بدن، قبل از هر چیز وجود لامین C ضروری است.
در گزارش گروهی از دانشمندان دانشگاه ماساچوست (ژوئیه 2007)، یک واقعیت جالب ارائه شده است: جهش در ژن LMNB1 منجر به این واقعیت شد که محور هسته در سلول ها موقعیت خود را تغییر داد و در نتیجه، چرخش هسته ها مشاهده شد. این جهش ها بر تحرک اسکلت سلولی تأثیری نداشت. اگر محققان cDNA نوع وحشی را در سلولهای موش LMNB1 -/- بیان کنند، چرخش هستهها متوقف میشود. به گفته دانشمندان، لامین B1 ممکن است یک عملکرد لنگر داشته باشد، و ارتباطی بین پوشش هسته و اسکلت سلولی ایجاد کند. موش های معیوب در ژن LMNB1 در مراحل اولیه رشد مردند.
بنابراین، تا به امروز، داده های بسیار جالب و جالبی به دست آمده است که نشان دهنده اهمیت اساسی ژن هایی است که ساختار و عملکرد لامین ها را کنترل می کنند. با این حال، تأثیر لامین ها بر فعالیت حیاتی و عملکرد ارگانیسم به عنوان یک کل هنوز به خوبی درک نشده است و نیاز به مطالعه بیشتر دارد. شاید این منجر به کشف فرصت های جدید برای مبارزه با پیری و باز کردن راه های واقعی برای طول عمر فعال شود.
بازگشتهمچنین بخوانید:
05 ژوئن 2008فقط یک ژن - و یک دسته کامل از بیماری ها
منحصر به فرد بودن پروتئین XPD، که برای ترمیم آسیب DNA ضروری است، در این واقعیت نهفته است که جهش در بخش های مختلف ژن آن زمینه ساز سه بیماری است.
خوانده شده در 21 مه 2008ایالات متحده برنامه ملی بیماری های بی نام را راه اندازی کرد
مؤسسه ملی بهداشت ایالات متحده برنامه ای را برای کار با بیمارانی که بیماری هایشان آنقدر نادر است که هنوز حتی نامی ندارند آغاز می کند.
خوانده شده در 27 فوریه 2008جهش یافته ها را از بین ببرید
ارگانیسم یک حیوان بالاتر می تواند به طور بسیار موثری از شر میتوکندری های جهش یافته خلاص شود: آنها پس از 2-6 نسل ناپدید می شوند. انتخاب میتوکندری های طبیعی در سلول های زایای زن یا در سطح درون سلولی اتفاق می افتد.
خوانده شده در 08 فوریه 2008بیماری های ارثی: اکنون می توان شناسایی کرد، برای درمان - نه به زودی
تا همین اواخر، بیماریهای عمدتاً تک ژنی که با اختلال در یک ژن اتفاق میافتند، مورد مطالعه قرار گرفتهاند. اما بیشتر بیماری های ارثی با اختلال همزمان چندین ژن و تأثیر خاصی از محیط خارجی همراه است.
خوانده شده در 28 اوت 2007ژن های اسکیزوفرنی را در کوه ها جستجو می کنند
دانشمندان گروه سازگاری ژنتیکی انسان موسسه ژنتیک عمومی. N.I. موسسه واویلف آکادمی علوم روسیه چندین دهه است که با مطالعه نمایندگان مردم بومی داغستان در تلاش است تا ژن های مسئول بیماری های مزمن را شناسایی کند. در حال حاضر توجه محققان بر روی ژن هایی متمرکز شده است که وقوع اسکیزوفرنی را از پیش تعیین می کنند.
خوانده شده در 08 ژوئیه 2008از نتیجه گیری خسته کننده بپرهیزید
برنده جایزه نوبل که 80 ساله شد، تاکید کرد که هرگز علاقه خود را به علم از دست نداده است. در همان زمان، در کمال تعجب بسیاری، واتسون گفت که در تمام این سالها در زمانی که مسئولیت آزمایشگاه را برعهده داشت، عملاً با آن سروکار نداشت.
سرگئی لاوروف گفت: شکستن پیمان منع موشکهای هستهای میانبرد (INF) خطر درگیری هستهای را افزایش میدهد. به گفته وزیر امور خارجه روسیه به خروج آمریکا از توافق با ابزارهای نظامی-فنی پاسخ خواهد داد
سرگئی لاوروف (عکس: ولادیمیر استاپکوویچ / ریانووستی)
به گزارش ریانووستی، رئیس وزارت خارجه روسیه در سخنانی در یکی از دانشگاههای پایتخت قرقیزستان درباره تصمیم واشنگتن برای خروج از معاهده INF اظهار نظر کرد. به گفته وزیر، ما در مورد ظهور عصر جدیدی صحبت می کنیم، زمانی که ایالات متحده "مسیری را برای نابودی کل سیستم کنترل تسلیحات تعیین کرده است."
لاوروف همچنین به برنامه های آمریکا برای ساخت سلاح های هسته ای کم بازده اشاره کرد. به گفته وی، همه اینها آستانه استفاده از سلاح های هسته ای را کاهش می دهد و خطر درگیری را افزایش می دهد.
وزیر روسیه پیشنهاد کرد که نتیجه آنچه اتفاق افتاد، توسعه جنگ سرد و مسابقه تسلیحاتی خواهد بود. با این حال، مسکو به تهدیدهای نوظهور با "وسایل فنی- نظامی" پاسخ خواهد داد.
در مورد چشم انداز گفتگوی روسیه و آمریکا در مورد ثبات استراتژیک، لاوروف ابراز امیدواری کرد که "ایالات متحده برای درک مسئولیت خود در قبال مشکلات ایجاد شده توسط سیاست خود، آماده شود. وزیر امور خارجه گفت: «پس خوش آمدید، درها باز است، ما با در نظر گرفتن منافع مشروع یکدیگر و نه واهی، در شرایط مساوی صحبت خواهیم کرد».
روسیه به اقدامات مقامات آمریکایی پاسخ داد. ولادیمیر پوتین رئیس جمهور روسیه در دیدار با لاوروف و وزیر دفاع سرگئی شویگو از تعلیق مشارکت در این معاهده خبر داد. در عین حال، رئیس دولت تاکید کرد که روسیه قصد ندارد وارد یک مسابقه تسلیحاتی شود که برای مسکو هزینه بر است.
دلیل این تصمیم آمریکا موشک کروز روسی 9M729 بود که با استفاده از پرتابگرهای اسکندر-ام پرتاب می شود. مقامات آمریکایی با متهم کردن روسیه به نقض معاهده INF خواستار تعلیق توسعه این موشک شدند. مسکو این اتهامات را رد می کند. سرگئی لاوروف گفت: طرف آمریکایی از سال 1999، زمانی که ایالات متحده آزمایش هواپیماهای بدون سرنشین جنگی را آغاز کرد، شروع به نقض توافق کرد.
معاهده نیروهای هسته ای میان برد در سال 1987 بین ایالات متحده و اتحاد جماهیر شوروی به امضا رسید. آزمایش، ساخت و استفاده از موشک های زمینی با برد کوتاه تر (از 500 تا 1000 کیلومتر) و برد متوسط (از 1000 تا 5500 کیلومتر) را ممنوع می کند. طرفین همچنین متعهد شدند که این سامانه های موشکی را که در حال حاضر در خدمت هستند، ظرف سه سال پس از امضای معاهده INF منهدم کنند. خروج از این معاهده امکان بازگشت به توسعه و تولید چنین سلاح هایی را فراهم می کند.
معرفی. در سال های اخیر، در ارتباط با موفقیت های ژنتیک مولکولی، که منجر به نقشه برداری و شناسایی ژن های تعداد قابل توجهی از بیماری های ارثی تک ژنی شد، مشکلاتی در ایجاد ساختار طبقه بندی آنها شروع شد. به عنوان مثال، جهش در یک ژن می تواند هم به تظاهر اشکال بالینی یک بیماری با شدت متفاوت (ناهمگنی آللی) و هم منجر به ظهور تظاهرات بالینی مختلف اشکال nosological (به اصطلاح "سری آللی") شود. یکی از گروه های بیماری های تشکیل دهنده سری آللی، لامینوپاتی ها هستند. آنها به دلیل جهش در ژن LMNA ایجاد می شوند که منجر به تغییر در ساختار و عملکرد پروتئین لامین A / C می شود (لامینوپاتی ها بیماری هایی هستند که در نتیجه جهش در ژن های پروتئین لایه هسته ای ایجاد می شوند - به زیر مراجعه کنید).
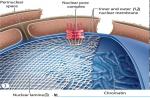
مشخص است که پوسته هسته سلولی شامل سه جزء اصلی است (شکل را ببینید): 1 ] غشای خارجی، [ 2 ] غشای داخلی و [ 3 ] صفحه نازک هسته ای که در زیر آن قرار دارد - لایه هسته ای (صفحه: lat. - lamina)، که توسط کمپلکس های پروتئینی تشکیل شده است که شامل گروه های مختلفی از لامین ها (پروتئین های لامین - زیر را ببینید). رشتههای لامین دایمرهای ابرپیچپیچ موازی را تشکیل میدهند که برای تشکیل یک شبکه رشتهای در سمت نوکلئوپلاسمی غشای هستهای داخلی، پلیمریزه میشوند و کمپلکسهای چندپروتئینی غشای هستهای درونی و بیرونی را لنگر میاندازند (توجه: لامینها یک رشته میانی کلاس 5 هستند که در همه سلولهای یوکاریوتی یافت میشوند. در تمام سلول های دارای هسته تشکیل شده).

بنابراین، لامین ها پروتئین های ساختاری هستند (دارای جرم 60 - 89 کیلو دالتون)، اجزای لایه هسته ای (لامینای هسته ای) - یک شبکه پروتئینی که در زیر غشای داخلی هسته قرار دارد و اندازه و شکل آن را تعیین می کند (یعنی در مکانیکی شرکت می کند. چسبندگی و تعامل بین اسکلت هسته و پروتئین های اسکلت سلولی). لایه هسته ای به پوشش هسته ای و سازماندهی منافذ هسته ای استحکام می دهد، در برابر نیروهای تغییر شکل مقاومت می کند و کروماتین را از آسیب فیزیکی محافظت می کند. همانطور که توسط مطالعات اخیر نشان داده شده است، همراه با عملکرد ساختاری، لامین ها در کنترل تکثیر DNA، سازماندهی کروماتین، و در تنظیم بیان ژن، پردازش و آپوپتوز نقش دارند.
همانطور که در بالا ذکر شد، لایه هسته ای از چهار پروتئین لامین تشکیل شده است: A، B1، B2 و C. لامین های B1، B2 (همچنین لامین های نوع B نیز نامیده می شوند) توسط دو ژن LMNB1 و LMNB2 (واقع در کروموزوم های 5q23 و 19q13) کدگذاری می شوند. به ترتیب) و در تمام سلول های جانوران چند سلولی سنتز می شوند. لامینهای A و C (به اصطلاح لامینهای نوع A [یا لامین A/C]) محصولات پیوند جایگزین یک ژن LMNA هستند (واقع در اولین کروموزوم 1q21.2-q21.3 و متشکل از 12 اگزون) و در مقادیر قابل مقایسه در بافت های تمایز یافته همه مهره داران، از جمله. شخص
پست رو هم بخون: نامگذاری کروموزوم های انسانی(به وب سایت)
توجه داشته باشید! مطالعات اخیر زمینه ای را فراهم می کند که لامین ها را به عنوان یکی از پروتئین های اصلی در نظر بگیریم که همزمانی پوسیدگی و ترمیم غشای هسته ای را در طول تقسیم سلولی تضمین می کند. نشان داده شده است که در پروفاز تقسیم سلولی، لامین ها فسفریله می شوند که منجر به تجزیه آنها می شود که سیگنالی برای تخریب پوشش هسته ای است. در مقابل، لامین ها در تلوفاز دفسفریله می شوند که منجر به تجمع آنها می شود. اعتقاد بر این است که فرآیند رپولاریزاسیون لامین باعث ترمیم پوشش هسته ای می شود. این توسط داده هایی پشتیبانی می شود که در پروفاز چرخه سلولی، اتصال لامین ها با قطعات غشای متلاشی شده هسته ای حفظ می شود و آنها نوعی "برچسب" برای قطعات غشای هسته ای در طول بازسازی آن هستند.
بنابراین، وظایف اصلی لامین ها عبارتند از: 1 ] 1 نقش کلیدی در حفظ شکل و یکپارچگی پوشش هسته ای. [ 2 ] سازماندهی و توزیع کروماتین منافذ هسته ای. [ 3 سازماندهی فضایی فرآیندهای تکثیر و رونویسی DNA، رویدادهای میتوزی و آپوپتوز. [ 4 ] مشارکت در مسیرهای سیگنالینگ مختلف. [ 5 ] سازماندهی ژنوم.
جهش های ژن LMNA مسئول ایجاد بیش از دوازده بیماری به نام لامینوپاتی هستند که بر بافت های مختلف هم به صورت مجزا (عضله اسکلتی و میوکارد، بافت چربی، اعصاب محیطی) و هم به صورت سیستمیک (سندرم پیری زودرس) تأثیر می گذارند. فنوتیپ های همپوشانی نیز ذکر شده است. همراه با تنوع بالینی گسترده، ناهمگنی ژنتیکی برجسته نیز مشخصه است.
توجه داشته باشید! تا به امروز، جهش در ژن LMNA (کد کننده لامین های نوع A [لامین A/C]) به عنوان یک عامل اتیولوژیک 11 نشان داده شده است. ! ) اشکال nosological مستقل که بخشی از پنج گروه بیماری های ارثی هستند - دیستروفی های عضلانی پیشرونده، کاردیومیوپاتی های گشاد شده، لیپودیستروفی ها، نوروپاتی های حسی حرکتی ارثی و سندرم های پیری زودرس. اغلب، جهش در ژن LMNA منجر به آسیب به ماهیچههای اسکلتی، میوکارد و بافت چربی میشود؛ در موارد بسیار کمتر، این جهشها عاملی سببشناختی در سندرمهای پروژروئید، نوروپاتیهای ارثی و درموپاتی محدودکننده کشنده هستند. در عین حال، سندرم های فوق می توانند به دلیل جهش هم در ژن های خود لامین ها و هم در ژن های پروتئین های شریک (SREBP1، emerins) و آنزیم های دخیل در پردازش لامین ها ایجاد شوند.
 توجه داشته باشید: MD ED - دیستروفی عضلانی Emery-Dreyfuss; KP MD - دیستروفی عضلانی اندام-کمربند. MD - دیستروفی عضلانی؛ DCMP - کاردیومیوپاتی متسع؛ KMP - کاردیومیوپاتی؛ AD - وراثت اتوزومال غالب؛ AR - توارث اتوزومال مغلوب
توجه داشته باشید: MD ED - دیستروفی عضلانی Emery-Dreyfuss; KP MD - دیستروفی عضلانی اندام-کمربند. MD - دیستروفی عضلانی؛ DCMP - کاردیومیوپاتی متسع؛ KMP - کاردیومیوپاتی؛ AD - وراثت اتوزومال غالب؛ AR - توارث اتوزومال مغلوب 
مکانیسم دقیق توسعه بیماری های مرتبط با لامین هنوز به طور دقیق مورد مطالعه قرار نگرفته است. دو فرضیه اصلی برای توضیح فنوتیپ های پاتولوژیک مشاهده شده غالب است: فرضیه ساختاری و فرضیه "بیان ژن". طبق اولی، فقدان لامین یا مونتاژ نادرست پروتئین های لامین جهش یافته منجر به کاهش قدرت لایه هسته ای و افزایش آسیب پذیری هسته و سلول به طور کلی می شود. اول از همه، سلول هایی که تحت فشار مکانیکی قرار می گیرند، مانند سلول های عضلانی و کاردیومیوسیت ها، با ایجاد تغییرات دژنراتیو رنج می برند. فرضیه دوم حاکی از اختلال در رابطه بین لایه هسته ای و عوامل رونویسی است. اخیراً فرضیه دیگری فرموله شده است که بر اساس آن جهش لامین های A/C یا عدم وجود لامین های نوع A می تواند مکانیسم سوم پاتوژنز - جداسازی موقت (به دلیل اختلال در یکپارچگی غشای هسته) را تحریک کند. تبادل ناکافی بین اجزای هسته ای و سیتوپلاسمی
اطلاعات بیشتر در مورد بیماری های مرتبط با لامین را در منابع زیر بخوانید:
مقاله "ویژگی های بالینی و ژنتیکی لامینوپاتی های ارثی" E.L. دادالی، د.س. بیلوا، I.V. اوگاروف مرکز علمی ژنتیک پزشکی آکادمی علوم پزشکی روسیه، مسکو؛ گروه ژنتیک، دانشکده پزشکی و زیستشناسی، دانشگاه پزشکی دولتی روسیه، مسکو (مجله "سالنامههای عصبشناسی بالینی و تجربی" شماره 4، 2008) [خواندن];
مقاله "جهش ژن لامین A/C (LMNA) در بیماران مبتلا به کاردیومیوپاتی گشاد شده و تظاهرات فنوتیپی آنها" Vaykhanskaya T.G., Sivitskaya L.N., Danilenko N.G., Kurushko T.V., Davydenko O.G. مرکز علمی و عملی جمهوری خواه "کاردیولوژی"، گروه عملکردی پاتوفیزیولوژی بالینی گردش خون، مینسک، بلاروس؛ مؤسسه علمی دولتی "موسسه ژنتیک و سیتولوژی"، آکادمی ملی علوم، آزمایشگاه توارث غیر کروموزومی، مینسک، بلاروس (مجله قلب و عروق اوراسیا، شماره 1، 2016) [خواندن]؛
پایان نامه برای درجه کاندیدای علوم پزشکی "تنوع بالینی و ژنتیکی و تشخیص مولکولی دیستروفی عضلانی Emery-Dreyfus" Adyan Tagui Avetikovna، FGBNU "مرکز تحقیقات ژنتیک پزشکی"، مسکو، 2015 [خواندن]؛
ارائه "Progeria - سندرم پروگریا هاچینسون-گیلفورد (HGPS)" S. Kokorin, E. Podkhalyuzina, V. Smirnov; سمینار زیست شناسی مولکولی; 2010/12/25 (bioinformaticsinstitute.ru) [خواندن]؛
مقاله "لیپودیستروفی جزئی خانوادگی (سندرم دانیگان) به دلیل جهش در ژن LMNA: اولین توصیف یک مورد بالینی در روسیه" E.L. سورکین، M.F. کلاشینکف، G.A. ملنیچنکو، A.N. تولیپاکوف؛ گروه غدد درون ریز، دانشکده پزشکی، SBEI HPE "اولین دانشگاه پزشکی دولتی مسکو به نام I.I. آنها سچنوف» از وزارت بهداشت روسیه، مسکو؛ موسسه بودجه ایالت فدرال "مرکز تحقیقات غدد درون ریز" وزارت بهداشت روسیه، مسکو (مجله "آرشیو درمانی" شماره 3، 2015) [خواندن]
© Laesus De Liro
لایه هسته ای (صفحه هسته ای) - یک شبکه پروتئین فیبریلار سفت و سخت که توسط پروتئین های لامینین (رشته های میانی) تشکیل شده است، زیر غشای هسته ای قرار گرفته و از آن حمایت می کند. این یک لایه فیبری از غشای هسته ای با مجتمع های منفذی است. توسط لایه ای متشکل از رشته های میانی در هم تنیده (لامین ها) که اسکلت کاریوس را تشکیل می دهند، با پروتئین های انتگرال مرتبط است. رشتههایی از DNA کروموزومی به لایهی لامینا متصل میشوند، یعنی. در سازماندهی کروماتین نقش دارد. پروتئین های مجتمع های منافذ از نظر ساختاری با پروتئین های لایه هسته ای مرتبط هستند که در سازماندهی آنها نقش دارد. بنابراین، لایه نقش بسیار مهمی در حفظ شکل هسته، بسته بندی منظم کروماتین، سازماندهی ساختاری کمپلکس های منافذ و تشکیل کاریولما در حین تقسیم سلولی (تجزیه غشای هسته ای در پروفاز و ادغام در تلوفاز) ایفا می کند.
75. کروماتین. کروماتین - دانه ها و توده های کوچک است که در هسته سلول ها یافت می شود و رنگ (کروموس) را به خوبی درک می کند، از این رو نام آن است. از نظر شیمیایی، کروماتین از مجموعهای از DNA و پروتئین (شامل RNA نیز میباشد) و مربوط به کروموزومهایی است که با رشتههای نازک در هسته اینترفاز نشان داده میشوند و به عنوان ساختارهای جداگانه قابل تشخیص نیستند. کروماتین ماده کروموزوم است. کروماتین از فیبرهای کروماتین تشکیل شده است که می توانند به صورت شل یا فشرده در هسته قرار گیرند. بر این اساس، دو نوع کروماتین متمایز می شوند: یوکروماتین - کروماتین سست یا غلیظ شده (داسپرالیزه)، ضعیف با رنگ های اساسی رنگ آمیزی شده و در میکروسکوپ نوری قابل مشاهده نیست، برای رونویسی در دسترس است. هتروکروماتین - کروماتین فشرده یا متراکم (مارپیچ)، به خوبی با همان رنگ ها رنگ می شود و در زیر میکروسکوپ نوری قابل مشاهده است. در حین آماده سازی یک سلول برای تقسیم (اینترفاز)، فیبرهای کروماتین در هسته مارپیچی می شوند و کروماتین به کروموزوم تبدیل می شود. پس از تقسیم در هسته سلول های دختر، از بین رفتن اسپیرال فیبرهای کروماتین رخ می دهد و کروموزوم ها دوباره به کروماتین تبدیل می شوند. بنابراین کروماتین و کروموزوم ها فازهای مختلف یک ماده هستند. بنابراین، با توجه به ویژگی های مورفولوژیکی هسته (با نسبت محتوای یو- و هتروکروماتین)، می توان فعالیت فرآیندهای رونویسی (عملکرد سنتزی سلول) را ارزیابی کرد که با افزایش آن، این نسبت به نفع تغییر می کند. با سرکوب کامل عملکرد هسته (به عنوان مثال، در سلول های آسیب دیده و در حال مرگ، در طول کراتینه شدن اپیتلیوم) اندازه آن کاهش می یابد، فقط حاوی هتروکروماتین است و با رنگ های اساسی به شدت و به طور یکنواخت رنگ می شود. این پدیده کاریوپیکنوزیس نامیده می شود. توزیع هتروکروماتین و نسبت محتوای eu- و هتروکروماتین مشخصه سلول های هر نوع است که امکان شناسایی آنها را فراهم می کند. در همان زمان، نظم های کلی در توزیع هتروکروماتین در هسته وجود دارد: تجمعات آن در زیر کاریولما، در ناحیه منافذ (به دلیل ارتباط آن با لایه) و اطراف هسته قطع شده است. توده های کوچکتر در سراسر هسته پراکنده شده اند. بدن Bar مجموعه ای از هتروکروماتین است که مربوط به یک کروموزوم X در زنان است که در اینترفاز پیچ خورده و غیرفعال است. در بیشتر سلولها، در نزدیکی کاریولما قرار دارد، و در گرانولوسیتهای خون مانند یک بخش کوچک اضافی از هسته ("چوب درام") به نظر میرسد. تشخیص بدن نوار (معمولا در سلول های اپیتلیال مخاط دهان) به عنوان یک آزمایش تشخیصی برای تعیین جنسیت ژنتیکی استفاده می شود.
76. کروماتین منتشر و متراکم (eu- و heterochromatin).
کروماتین - دانه ها و توده های کوچک است که در هسته سلول ها یافت می شود و رنگ (کروموس) را به خوبی درک می کند، از این رو نام آن است. از نظر شیمیایی، کروماتین از مجموعهای از DNA، RNA و پروتئین تشکیل شده است که در آن DNA در درجات مختلفی از تراکم قرار دارد و مربوط به کروموزومهایی است که با رشتههای نازک در هسته اینترفاز نشان داده میشوند و به عنوان ساختارهای جداگانه قابل تشخیص نیستند. کروماتین ماده کروموزوم است. کروماتین از فیبرهای کروماتین تشکیل شده است که می توانند به صورت شل یا فشرده در هسته قرار گیرند. بر این اساس، دو نوع کروماتین متمایز می شوند: یوکروماتین - کروماتین سست یا غلیظ شده (داسپرالیزه)، ضعیف با رنگ های اساسی رنگ آمیزی شده و در میکروسکوپ نوری قابل مشاهده نیست، برای رونویسی در دسترس است. هتروکروماتین - کروماتین فشرده یا متراکم (مارپیچ)، به خوبی با همان رنگ ها رنگ می شود و در زیر میکروسکوپ نوری قابل مشاهده است. در حین آماده سازی یک سلول برای تقسیم (اینترفاز)، فیبرهای کروماتین در هسته مارپیچی می شوند و کروماتین به کروموزوم تبدیل می شود. پس از تقسیم در هسته سلول های دختر، از بین رفتن اسپیرال فیبرهای کروماتین رخ می دهد و کروموزوم ها دوباره به کروماتین تبدیل می شوند. بنابراین کروماتین و کروموزوم ها فازهای مختلف یک ماده هستند. بنابراین، با توجه به ویژگی های مورفولوژیکی هسته (با نسبت محتوای یو- و هتروکروماتین)، می توان فعالیت فرآیندهای رونویسی (عملکرد سنتزی سلول) را ارزیابی کرد که با افزایش آن، این نسبت به نفع تغییر می کند. با سرکوب کامل عملکرد هسته (به عنوان مثال، در سلول های آسیب دیده و در حال مرگ، در طول کراتینه شدن اپیتلیوم) اندازه آن کاهش می یابد، فقط حاوی هتروکروماتین است و با رنگ های اساسی به شدت و به طور یکنواخت رنگ می شود. این پدیده کاریوپیکنوزیس نامیده می شود. توزیع هتروکروماتین و نسبت محتوای eu- و هتروکروماتین مشخصه سلول های هر نوع است که امکان شناسایی آنها را فراهم می کند. در همان زمان، نظم های کلی در توزیع هتروکروماتین در هسته وجود دارد: تجمعات آن در زیر کاریولما قرار دارد، در ناحیه منافذ (به دلیل ارتباط آن با لایه) و اطراف هسته (دو هسته) قطع شده است. توده های کوچکتر در سراسر هسته پراکنده شده اند. بدن Bar مجموعه ای از هتروکروماتین است که مربوط به یک کروموزوم X در زنان است که در اینترفاز پیچ خورده و غیرفعال است. در بیشتر سلولها، در نزدیکی کاریولما قرار دارد، و در گرانولوسیتهای خون مانند یک بخش کوچک اضافی از هسته ("چوب درام") به نظر میرسد. تشخیص بدن نوار (معمولا در سلول های اپیتلیال مخاط دهان) به عنوان یک آزمایش تشخیصی برای تعیین جنسیت ژنتیکی استفاده می شود.